
【题目】元素周期表中短周期主族元素W、X、Y、Z,原予序数依次增大,W的液态单质应用于航天领域,是火箭起飞的重要燃料;X元素原子的最外层电子数是内层电子数的3倍;元素Y在自然界中只能以化合态存在,而且元素Y在组成海水盐类物质的所有元素中,质量分数为第二;Z元素原子在同周期中原子半径最小。下列说法错误的是( )
A.Z的单质与W、Y的单质都能反应,且反应中Z的单质都作氧化剂
B.X的单质与Y的单质在常温条件下反应生成化合物甲,用电子式表示甲的形成过程为:![]()
C.Y与W可以形成原子个数比为1:1的化合物乙,且乙与水反应有气体产生
D.W与X形成的含有极性共价键的化合物不只有一种
【答案】B
【解析】
W原子序数最小且液态单质是火箭起飞的重要燃料,W为氢元素;X元素原子的最外层电子数是内层电子数的3倍,则X为氧元素;元素Y在组成海水盐类物质(NaCl、MgCl2、CaCl2等)的所有元素中,质量分数为第一的是氯元素,第二的是钠元素,则Y为钠元素;Z的原子序数最大且在同周期中原子半径最小,则Z为氯元素。
A.Z的单质与W、Y的单质都能反应,氯气与氢气、钠反应中,将氢气、钠分别氧化为氯化氢和氯化钠,表现强氧化性,A正确;
B.X的单质与Y的单质反应时,钠与氧气常温下反应生成氧化钠,氧化钠的形成过程为![]() ,B错误;
,B错误;
C.Y与W可以形成原子个数比为1:1的化合物NaH,NaH与水反应发生反应生成氢气,C正确;
D.W 与X形成的含有共价键的化合物有H2O、H2O2,二者均含有极性共价键,D正确;
故选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列各对物质中,互为同系物的是
A. CH3-CH=CH2与![]() B.
B. ![]() 与
与![]()
C. 甲苯和二甲苯D. CH2=CH—CH=CH2和CH3CH2CH2C≡CH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
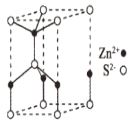
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
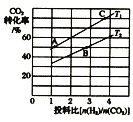
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法能说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是( )
H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmol H2的同时生成nmol HI
②一个H-H键断裂的同时有两个H-I键断裂
③当v正(HI)=2v逆(I2)时
④反应速率:v(H2)=v(I2)=0.5v(HI)
⑤当c(H2):c(I2):c(HI)=1:1:2时
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和体积一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再发生变化
⑩温度和压强一定时,混合气体的密度不再发生变化
A.②③⑥⑨B.①②⑤⑨⑩C.③⑥⑦⑩D.②⑥⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备硫酸的主要反应之一为SO2与O2反应生成SO3。请回答下列问题:

(1)SO2与O2反应生成SO3的反应过程的能量变化如图1所示。由图中曲线变化可知,该反应为___(填“放热”或“吸热”)反应。
(2)其他条件不变时,不同温度下SO2的转化率随时间的变化情况如图2所示T1___(填“>”或“<”)T2。
(3)某次实验中,在容积为2L的恒温恒容密闭容器中通入2molSO2和bmolO2,反应过程中部分物质的物质的量随反应时间的变化如图3所示。
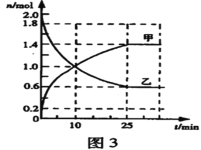
①甲为___(填化学式,下同),乙为___。
②SO2与O2生成SO3的反应是___反应。(填“可逆”或“不可逆”)
③10min时,v正(SO2) _______ v逆(SO2)。(填“>”、“<”或“=”)
④从反应开始到平衡,反应速率v(SO3)=___。
⑤当b=___时,O2与SO2的转化率相等。
⑥反应达到平衡时,SO2的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
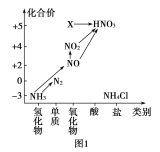
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为_________。
(2)下列试剂不能用于干燥NH3的是__________。
A.浓硫酸 B.碱石灰 C.NaOH固体
(3)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO的化学方程式为______________。
②NO→NO2反应的实验现象是____________。
③NO2+H2O→HNO3中氧化剂与还原剂物质的量之比为______。
(4)图1中,实验室只用一种物质将NO直接转化为硝酸且绿色环保,则该物质的化学式为_____。
(5)若要将NH3→N2,从原理上看,下列试剂可行的是______。
A.O2 B.Na C.NH4Cl D.NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(1),生成2mol液态水放出572kJ的能量,请回答下列问题:
①生成物能量总和___(填“大于”“小于”或“等于”)反应物能量总和。
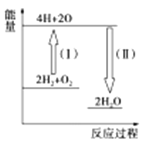
②反应2H2+O2![]() 2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
2H2O的能量变化如图所示。已知拆开1mol H2、1mol O2和1mol H—O中的化学键分别需要消耗436kJ、496kJ和463kJ的能量。则反应过程(Ⅱ)____(填“吸收”或“放出”)___kJ。
(2)一定温度下,在容积为2L的密闭容器中进行反应:aN(g)![]() bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g)+cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
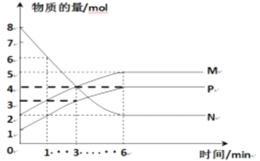
①反应化学方程式中各物质的系数比为a:b:c=____。
②1min到3min这段时刻,以M的浓度变化表示的平均反应速率为:_______。
③下列叙述中能说明上述反应达到平衡状态的是_________。
A 反应中当M与N的物质的量相等时
B P的质量不随时间变化而变化
C 混合气体的总物质的量不随时间变化而变化
D 单位时间内每消耗a mol N,同时消耗b mol M
E 混合气体的压强不随时间的变化而变化
M 的物质的量浓度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com