
 如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:| 1000ρw |
| M |
| n |
| V |
| 1000×1.19×36.5% |
| 36.5 |
| 0.400mol/L×0.5L |
| 11.9mol/L |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
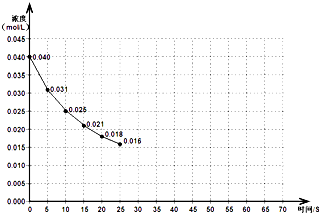
查看答案和解析>>
科目:高中化学 来源: 题型:
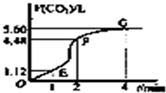 向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:
向200mL 6mol/L的盐酸中加入一定量的纯净CaCO3,产生气体的体积随时间的变化曲线如图所示(气体体积均在标准状况下测定).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
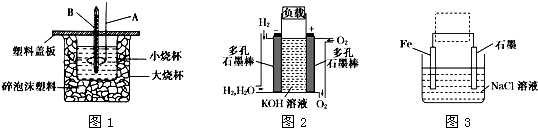
 某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:
某课外活动小组同学用右下图装置进行以下表格中的三组实验,两极各有一个盛满水倒扣的小试管用来收集气体,W为浸有饱和硫酸钠和酚酞混合溶液的滤纸片,试回答下列问题:| 实验编号 | X | Y | Z |
| ① | 铁 | 石墨 | 足量饱和食盐水 |
| ② | 石墨 | 石墨 | 足量KOH溶液 |
| ③ | ? | ? | 足量?溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com