
N、O、Si、S是重要的非金属元素,下列说法正确的是
A.N、O、S、Si的原子半径逐渐增大,非金属性逐渐减弱
B.氮的氧化物和硫的氧化物既是形成光化学烟雾,又是形成酸雨的主要物质
C.S、SO2和Si、SiO2四种物质均能与NaOH溶液反应,各自又能与某些酸反应
D.N、Si、S的单质均能和氧气反应,生成的产物分别是NO2、SiO2和SO2
科目:高中化学 来源: 题型:
在一定条件下MO3-与M-发生反应;MO3-+5M-+6H+ == 3M2+3H2O,则下列关于M元素的叙述中正确的是
A.M位于元素周期表的第VA族 B.M的氢化物的水溶液呈酸性
C.MO3-中的M元素只能被还原 D.M2在常温常压下一定是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
工业生产纯碱的工艺流程如下图所示:

请回答下列问题:
(1)工艺流程中多次用到“过滤”操作,过滤操作中用到的玻璃仪器有 。
(2)实验过程中先“氨化”,后“碳酸化”,理由是 。
(3)工业纯碱含有少量碳酸氢钠,某兴趣小组为测定某工业纯碱中碳酸钠的质量分数,设计了下列实验方案:
方案一:分别称量干燥坩埚(m1g)和纯碱样品的质量(m2g),将纯碱样品放人坩埚中充分加热。将坩埚置于干燥器中冷却后称量,重复“加热、冷却、称量”操作多次后,最终称量坩埚和剩余样品的总质量为m3g,则样品中纯碱的质量分数为
 (用含m1、m2、m3的代数式表示)
(用含m1、m2、m3的代数式表示)
方案二:正确称取样品w g,用右图装置进行实验。
①装置C中试剂是 。
②E装置的作用是 ,若不连接E装置所测Na2CO3的质量分数 (填“偏大”、“偏小”或“无影响”)。
③反应前通入N2,反应后继续通人N2的目的是 。
(4)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述) 。
②工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是 。(已知:酸性H2CO3>HClO>HCO3-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为2L的恒容密闭容器中发生反应xA(g)+yB(g) zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图7表示200℃时容器中A、B、C物质的量随时间的变化关系,图8表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
 | |||
 | |||
A.200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol•L-1•min-1
B.图8所知反应xA(g)+yB(g) zC(g)的ΔH>0,且a=2
zC(g)的ΔH>0,且a=2
C.若在图7所示的平衡状态下,再向体系中充入He,此时v正>v逆
D.200℃时,向容器中充入2 mol A 和1 mol B,达到平衡时,A 的体积分数小于0.5
查看答案和解析>>
科目:高中化学 来源: 题型:
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质见下表:
| 物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) /g·cm—3 | 溶解性 |
| 甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
| 乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
| 3,5—二甲氧基苯酚 |
| 33~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是 ▲ 。
②萃取用到的分液漏斗使用前需 ▲ 并洗净,分液时有机层在分液漏斗的
▲ (填“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3 溶液洗涤的目的是 ▲ ;用饱和食盐水洗涤的目的是 ▲ 。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是 ▲ (填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先 ▲ ,
再 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
黄铜矿是工业炼铜的主要原料,主要成分为CuFeS2,含少量脉石。为测定该黄铜矿的纯度,某同学设计了如下实验:
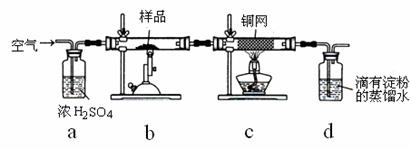
现用电子天平称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的1/10置于锥形瓶中,用0.05mol•L-1标准碘溶液进行滴定,消耗标准碘溶液20.00mL。请回答下列问题:
(1)将样品研细后再进行反应,其目的是 ;
标准碘溶液应盛放在(填“碱式”或“酸式”) 滴定管中。
到达滴定终点的现象
(2)装置a的作用是 。
A.除去空气中的二氧化碳 B.除去空气中的水蒸气
C.有利于气体混合 D.有利于观察、控制空气流速
(3)若去掉c装置,会使测定结果(填“偏低”、“偏高”或“无影响”) ,写出影响测定结果的化学方程式 。
(4)上述反应结束后,仍需通一段时间的空气,其目的是 。
(5)通过计算可知,该黄铜矿的纯度为 。
(6)假设实验操作均正确,测得的黄铜矿纯度仍然偏低,可能的原因主要有
。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述正确的是
A.同系物间有相似的化学性质。
B.同分异构体间有相似的化学性质。
C.分子组成上相差一个“CH2”原子团的两种有机物必定互为同系物。
D.相对分子质量相等的两种有机物必定是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某有机物的结构为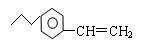 ,请完成下列问题:
,请完成下列问题:
(1)该有机物的分子式为 ;1mol该有机物完全燃烧需要消耗 mol氧气;
(2)写出该有机物与溴的四氯化碳溶液反应的化学方程式 ;
(3)该有机物与氢气完全反应,需要消耗 mol氢气。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(aq)(红色)  H+(aq)+In-(aq)(黄色)
H+(aq)+In-(aq)(黄色)
浓度为0.02 mol/L的下列各溶液:①盐酸;②石灰水;③NaCl溶液;④NaHSO4溶液;⑤NaHCO3溶液;⑥氨水中,能使指示剂变红色的是( )
A.①④⑤ B.②⑤⑥ C.①④ D.②③⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com