
【题目】电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL 浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法错误的是
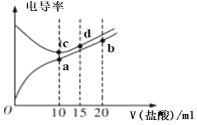
A.滴定氨水的过程应该选择甲基橙作为指示剂
B.a 点溶液中:c(H+)+c(NH4+)-c(OH-)=0.05 mol·L-1
C.b 点溶液中:c(H+)=c(OH-)+c(NH4+)+2c(NH3H2O)
D.a、b、c 三点的溶液中,水的电离程度c> b>a
【答案】D
【解析】
浓度均为0.100 mol·L-1的NaOH 溶液和氨水溶液中,NaOH为强碱,溶液中完全电离,氨水为弱电解质,部分电离,则溶液中的电导能力NaOH大于氨水,则a点所在的曲线为氨水溶液,c点所在的曲线为NaOH溶液;
A. 滴定氨水时,反应的生成物为氯化铵,溶液呈酸性,应该选择甲基橙作为指示剂,A正确;
B. a 点溶液中,溶质恰好为氯化铵根据溶液呈电中性:c(H+)+c(NH4+)=c(Cl-)+c(OH-),此时溶液中c(Cl-)=0.100 mol/L×10mL/20mL=0.05 mol·L-1,B正确;
C. b 点溶液中,盐酸过量,且生成的氯化铵与未反应的HCl的物质的量相等,根据物料守恒可得: c(Cl-)=2 c(NH4+) +2c(NH3H2O),根据溶液呈电中性:c(H+)+c(NH4+)=c(Cl-)+c(OH-),代入,消除c(Cl-)即可得到,C正确;
D. 酸与碱溶液对水的电离均有抑制作用,生成的氯化铵的水的电离有促进作用,a点为氯化铵、b点盐酸过量、c 点位氯化钠,则三点的溶液中,水的电离程度a >c> b,D错误;
答案为D


科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为![]() 的①
的①![]() 溶液 ②
溶液 ②![]() 溶液③
溶液③ ![]() 溶液各25mL,下列说法正确的是
溶液各25mL,下列说法正确的是
A.3种溶液pH的大小顺序是③>②>①
B.若将3种溶液稀释相同倍数,pH变化最大的是①
C.若分别加入25mL ![]() 盐酸后,pH最小的是②
盐酸后,pH最小的是②
D.若升高温度,则③的pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢一定条件下可发生分解:2H2O2(l)=2H2O(l)+O2(g),其能量变化如下图所示,下列说法正确的是
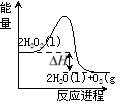
A.该分解反应为吸热反应
B.2molH2O2具有的能量小于2molH2O和1molO2所具有的总能量
C.加入MnO2或FeCl3均可提高该分解反应的速率
D.其他条件相同时,H2O2溶液的浓度越大,其分解速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2+B2=2AB,断开1molA2中的化学键消耗的能量为Q1 kJ,断开1molB2中的化学键消耗的能量为Q2 kJ,生成1molAB中的化学键释放的能量为Q3kJ,则下列说法正确的是
A. 若A2和B2的总能量之和大于生成的2AB的总能量,则反应放热
B. 若A2和B2的总能量之和小于生成的2AB的总能量,则反应放热
C. 若该反应为放热反应,则Q1+Q2<Q3
D. 若该反应为吸热反应,则Q1+Q2<Q3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】敌草胺是一种除草剂。它的合成路线如下:
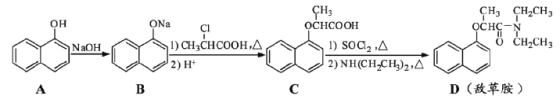
回答下列问题:
(1)在空气中久置,A由无色转变为棕色,其原因是______________________。
(2)C分子中不能与金属钠反应的官能团是______________________(填名称)。
(3)C转化为D的第一步反应有SO2生成,写出该反应的化学方程式______________。
(4)同时满足下列条件的C的同分异构体有______种。
①能与金属钠反应放出H2
②是萘的衍生物,且取代基都在同一个苯环上
③可发生水解反应,其中一种水解产物能发生银镜反应,另一种水解产物分子中有5种不同化学环境的氢
(5)若C不经提纯,产物敌草胺中将混有少量副产物E,E是一种由B和C生成的酯(变化过程中碳原子数未变),则E的分子式为___________________。
(6)已知:![]() ,若以苯酚和乙酸为原料制备
,若以苯酚和乙酸为原料制备![]() ,其合成路线为______________________。
,其合成路线为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaC2晶体的晶胞结构与NaCl的相似(如图),但CaC2晶体中含有哑铃形C22﹣的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )

A. 6.4 g CaC2晶体中含阴离子0.2 mol
B. 1个Ca2+周围距离最近且等距离的C22﹣数目为6
C. 该晶体中的阴离子与N2是互为等电子体
D. 与每个Ca2+距离相等且最近的Ca2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A. K=![]()
B. K=![]()
C. 增大c(H2O)或减小c(H2),会使该反应平衡常数减小
D. 改变反应的温度,平衡常数不一定变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(1)下图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,写出N2和H2反应的热化学方程式:____________________.

(2)若已知下列数据:试根据表中及图中数据计算N-H的键能____________kJ·mol-1.
化学键 | H-H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1___________,E2 _________ (填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如4NH3(g)+3O2(g)=2N2(g)+6H2O(g);ΔH1= a kJ·mol-1N2(g)+O2(g)=2NO(g);ΔH2=b kJ/mol若1mol NH3还原NO至N2,写出该反应的热化学方程式__________(ΔH用a、b表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,![]() ,常温下
,常温下![]() 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
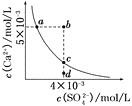
A.在任何溶液中,![]() 、
、![]() 均相等
均相等
B.b点将有沉淀生成,平衡后溶液中![]() 一定等于
一定等于![]()
C.a点对应的![]() 等于c点对应的
等于c点对应的![]()
D.d点溶液通过蒸发可以变到c点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com