
| A. | 惰性电极电解饱和食盐水,若电路中通过NA个电子,则阳极产生气体11.2L | |
| B. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| C. | 1 mol C12发生化学反应,转移的电子数必为2NA | |
| D. | 标准状况下,4.0 g CH4中含有共价键的数目为NA |
分析 A、阳极产生的氯气所处的状态不明确;
B、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子,生成3mol碘;
C、氯气反应后的价态不明确;
D、求出甲烷的物质的量,然后根据1mol甲烷中含4mol共价键来分析.
解答 解:A、阳极产生的氯气所处的状态不明确,故其体积不能计算,不一定是11.2L,故A错误;
B、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子,生成3mol碘,故当生成3mol碘时转移5NA个电子,故B错误;
C、氯气反应后的价态不明确,故1mol氯气发生反应转移的电子数不一定是2NA个,故C错误;
D、4g甲烷的物质的量为0.25mol,而1mol甲烷中含4mol共价键,故0.25mol甲烷中含NA条共价键,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
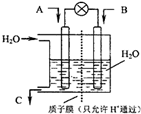 面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
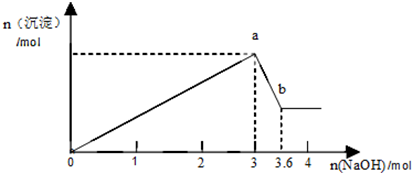
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同 | |
| B. | 蔗糖、麦芽糖的分子式都是C12H22O11,它们互为同分异构体 | |
| C. | “地沟油”可通过水解制得肥皂 | |
| D. | 苯不能使酸性KMnO4溶液褪色,因此苯不能发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
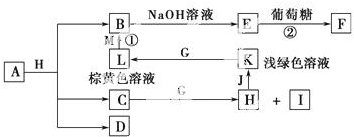
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
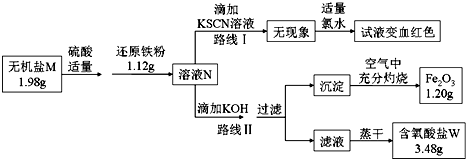
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com