
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
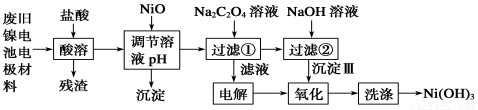
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。②K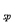 (Ni(OH)
(Ni(OH) ): 5.0×10-16 , K
): 5.0×10-16 , K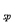 (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物之一 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀?
。
(1)碳粉
(2)Fe(OH)3、Al(OH)3 把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3) NiCl2+Na2C2O4==NiC2O4↓+2NaCl
(4) NiC2O4 +2OH- 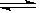 Ni(OH)2+C2O42- 8.0×105L.mol-1
Ni(OH)2+C2O42- 8.0×105L.mol-1
(5) Cl2 往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~2次。
【解析】
试题分析:(1)由于电极材料是由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成的,因此在这些成分中不溶于酸的只有碳粉,所以酸溶后所留残渣为碳粉。
(2)酸溶后的溶液中含有Al3+ 、Fe3+ 、Ni2+ 等金属离子,因此加入NiO主要是调节pH值使杂质离子Al3+ 、Fe3+ 沉淀,所以析出的沉淀为Fe(OH)3、Al(OH)3 。用pH试纸测定溶液pH值的操作是:把干燥pH试纸置于表面皿(或玻璃片)上,用干燥洁净的玻璃棒蘸取待测液滴在pH试纸上,待显色后立即与标准比色卡比对即可读数。
(3)除去Al3+ 、Fe3+ 等杂质离子后的溶液为NiCl2 溶液,加入Na2C2O4溶液后又经过了过滤步骤,可以推测此步骤中反应有沉淀析出,因此发生的反应方程式为NiCl2+Na2C2O4==NiC2O4↓+2NaCl。
(4)加NaOH溶液到NiC2O4 沉淀中,根据已知条件中Ni(OH) 、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH-
、NiC2O4的溶度积,可以分析两种沉淀的溶解度较接近,因此此处应该是发生了沉淀的转化反应,所以方程式为NiC2O4 +2OH-  Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
Ni(OH)2+C2O42- ,此转化方程式可由两沉淀的溶解平衡式结合而得:
①Ni(OH)2 = Ni2+ +2OH- K (Ni(OH)
(Ni(OH) )= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K
)= 5.0×10-16 ②NiC2O4 = Ni2+ + C2O42- K (NiC2O4)=4.0×10-10 ,
(NiC2O4)=4.0×10-10 ,
由所求方程式可由②—①得,因此该式的平衡常数K= K (NiC2O4)/ K
(NiC2O4)/ K (Ni(OH)
(Ni(OH) )= 8.0×105L.mol-1 。
)= 8.0×105L.mol-1 。
(5)过滤1后的滤液是氯化钠溶液,因此电解氯化钠溶液能得到氧化性的气体氯气。洗涤Ni(OH)3 沉淀的操作是:往盛有Ni(OH)3 沉淀的漏斗中注入蒸馏水至浸没沉淀,待水自然流干后,再重复2~3次。
考点:本题考查的是简单的化学工艺流程题,考查的操作较多。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014学年江苏省高三年级模拟考试化学试卷(解析版) 题型:选择题
依曲替酯是一种皮肤病用药,它可以由原料X经过多步反应合成。
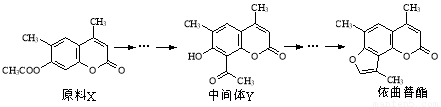
下列说法正确的是
A.原料X与中间体Y互为同分异构体
B.原料X可以使酸性KMnO4溶液褪色
C.中间体Y能发生加成、取代、消去反应
D.1 mol依曲替酯只能与1 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述正确的是(相对原子质量:D-2 O-16 Cu-64)
A.18 g的D216O中含有的中子数为9 NA
B.物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA
C.33.6 L NO2溶于足量的水得到的溶液中含有的NO3-数为NA
D.32 g铜发生氧化还原反应,一定失去NA个电子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:填空题
为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下:
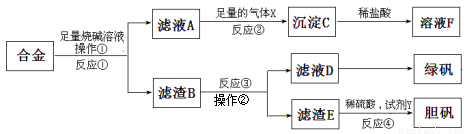
请回答:
(1)绿矾的化学式为 。
(2)写出反应①的化学方程式 ,反应②生成沉淀的离子反应方程式 。
(3)为了检测滤液D中含有的金属离子,可设计实验方案为(试剂自选): 。
(4)在滤渣B中滴加稀硫酸时,发现反应速率比一般的铁粉反应要快,其原因是 。
(5)若考虑绿色化学工艺,在滤渣E中加入稀硫酸和试剂Y制胆矾晶体,试剂Y为无色液体,则反应④的总化学方程式为 ;若不考虑绿色化学工艺,所选试剂Y为1mol/L的硝酸,欲使3molCu全部溶解且溶液中含铜元素的溶质仅为CuSO4,则需该硝酸的体积 L。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省肇庆市高三级第一次模拟考试理综化学试卷(解析版) 题型:选择题
实验室中以下物质的贮存方法不正确的是
A.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
B.保存硫酸亚铁溶液时,要向其中加入少量硫酸和铁粉
C.少量金属钠保存在煤油中
D.试剂瓶中的液溴可用水封存,防止溴挥发
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
高炉炼铁过程中发生的反应: Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)
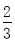 Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
Fe(s)+CO2(g),已知该反应在不同温度下的平衡常数如下表,下列说法不正确的是( )
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
A.△H<0
B.该反应的平衡常数表达式是K=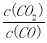
C.其他条件不变,向平衡体系充入CO2气体,K值减小
D.其他条件不变,升高温度,可以降低CO的平衡转化率
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省清远市高三4月模拟理综化学试卷(解析版) 题型:填空题
锶(Sr)为第五周期ⅡA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
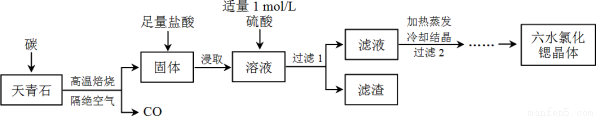
已知:① 经盐酸浸取后,溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质;
② SrSO4、BaSO4的溶度积常数分别为3.3×10-7、1.1×10-10;
③ SrCl2·6H2O的摩尔质量为:267 g/mol。
(1)天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)为了得到较纯的六水氯化锶晶体,过滤2后还需进行的两步操作是_______________。
(4)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5 mol/L)。
(5)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO3 1.100×10-2 mol的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应的离子),待Cl―完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+ 以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省深圳市高三第二次调研考试理综化学试卷(解析版) 题型:选择题
下列实验现象对应的结论正确的是( )
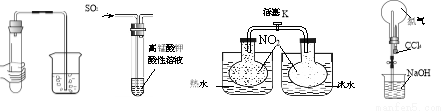
①气密性检查 ②气体性质检验 ③化学平衡的探究 ④喷泉实验
选项 | 现象 | 结论 |
A | ①中导管口冒气泡,手松开无现象 | 气密性良好 |
B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省十校联考高三下学期理综化学试卷(解析版) 题型:实验题
某研究小组对“Br2和I2能否将Fe2+氧化为Fe3+”这一课题进行实验和探究。请你完成相关问题的回答。
(1)提出合理的假设
假设1: Br2和I2都可以将Fe2+氧化为Fe3+;
假设2: Br2和I2都不能将Fe2+氧化为Fe3+;
假设3:
(2)实验验证
在大试管中加适量铁粉,加入10 mL 稀硫酸,振荡试管,充分反应后,铁粉有剩余,将所得的FeSO4溶液稀释到200mL,备用。
实验Ⅰ:向试管1中加入2 mL浅绿色的 FeSO4溶液,再滴加少量红棕色的溴水,振荡试管,溶液为黄色;
实验Ⅱ:向试管2中加入2 mL浅绿色的 FeSO4溶液,再滴加少量棕黄色的碘水,振荡试管,溶液为黄色。
(3)对实验现象的分析与讨论
①甲同学认为实验Ⅰ的现象说明溴水能将Fe2+氧化,离子方程式为 。
②乙同学认为应该补充实验,才能得出甲的结论。乙的实验操作以及预期现象是 。
③该小组同学对实验Ⅱ中溶液呈黄色的原因展开了讨论:
可能1:碘水与 FeSO4溶液不反应,黄色是碘水稀释后的颜色。
可能2: 。
丙同学和丁同学分别设计了以下实验方案以确定可能的原因。
丙方案:向试管2所得溶液中继续加入0.5mLCCl4,充分振荡,静置一段时间后。取出上层溶液,滴加几滴KSCN 溶液;
丁方案:向试管2所得溶液中继续加入加入0.5mL乙酸乙酯,充分振荡,静置一段时间后。取出下层溶液,滴加几滴KSCN 溶液;
你认为 方案为最佳方案,理由是 。
(4)拓展延伸
①为准确测定此实验所用的FeSO4溶液的浓度,某同学补充了以下实验:
滴定:量取20.00mL稀释后得到的溶液于锥形瓶中,将0.0200mol/LKMnO4标准溶液装入50mL中,滴定至终点,记录数据。重复滴定2次。平均消耗KMnO4溶液V mL。
②计算:此实验中所用的FeSO4溶液的物质的量浓度= mol/L(要求只列出算式,不需运算)。
(已知反应式:Fe2+ + MnO4- +H+ — Fe3+ + Mn2+ + H2O,未配平)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com