
【题目】常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
A. V一定等于0.2
B. V大于或等于0.2
C. 混合溶液中离子浓度一定满足:c(Cl-)>c(NH![]() )> c(H+)>c(OH-)
)> c(H+)>c(OH-)
D. 混合溶液中离子浓度一定满足:c(NH![]() )+c(H+)= c(Cl-)+c(OH-)
)+c(H+)= c(Cl-)+c(OH-)
科目:高中化学 来源: 题型:
【题目】2 mol A与2 mol B混合于2 L的密闭容器中,发生反应:2A(g)+3B(g)![]() 2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
2C(g)+zD(g),若2 s后,A的转化率为50%,测得v(D)=0.25 mol·L-1·s-1,下列推断正确的是( )
A.v(C)=0.2 mol·L-1·s-1
B.z=3
C.B的转化率为25%
D.C平衡时的浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝碱式碳酸盐MgaAlb(OH)c(CO3)d·xH2O是一种不溶于水的新型无机阻燃剂,其受热分解产物中的MgO、Al2O3熔点较高且都不燃烧,有阻燃作用。完成下列填空:
(1)组成镁铝碱式碳酸盐的三种非金属元素的原子半径从小到大的顺序是______________。碳原子最外层电子排布式是________________,铝原子核外有_________种能量不同的电子。
(2)将MgaAlb(OH)c (CO3)d·x H2O表示成氧化物的形式:2aMgO·bAl2O3·2dCO2·(________)H2O;
(3)焦炭与石英高温下在氮气流中发生如下反应,工业上可由此制得一种新型陶瓷材料氮化硅(Si3N4):3SiO2(s)+6C(s)+2N2(g)![]() Si3N4(s)+6CO(g) + Q (Q>0)。
Si3N4(s)+6CO(g) + Q (Q>0)。
①该反应中,氧化产物是________________________。若测得反应生成4.48 L CO气体(标准状况下),则转移的电子的物质的量为_____________。
②该反应的平衡常数表达式K=_____________________________;若升高温度,K值____________(填“增大”、“减小”或“不变”)。
③该反应的速率与反应时间的关系如右图所示,t4时刻引起正逆反应速率变化的原因是___________________________(写出一种即可)。
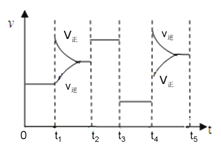
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.2 g Cu投入100 mL稀硫酸中加热,没有明显变化,若边加热边缓缓加入一定量H2O2,金属Cu逐渐溶解,则下列说法正确的是( )
A. 反应过程中有刺激性气味的气体生成
B. H2O2对Cu和稀硫酸的反应起催化作用
C. 若Cu和硫酸恰好完全反应,则稀硫酸的物质的量浓度为0.5 mol·L-1
D. 反应中硫酸既表现出酸性又表现出氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离或提纯物质的方法正确的是( )
A.用蒸馏的方法制取蒸馏水
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热、蒸发的方法可以除去CaCl2、MgCl2等杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硫化合物的种类很多,现有H2SO4、H2SO3、SO2、Na2SO3、BaSO4、CuSO4、Na2SO4这7种常见的含硫化合物。回答下列问题:
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式,并标明电子转移的方向和数目:_______________________________________。
(2)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应。为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面_______________________,则发生了钝化;若铁棒表面____________________,则未发生反应。
(3)用Na2SO3吸收法是治理SO2污染的一种方法,其原理为(用化学方程式表示): _______________________________________________________________。
(4)减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2,该反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为确定过氧化氢分解的最佳催化条件,用如图装置进行实验、反应物用量和反应停止的时间数据如下表:
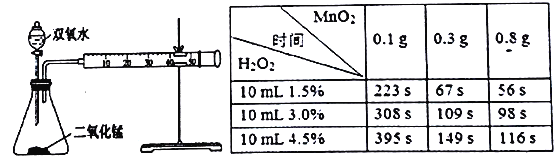
请回答下列问题:
(1)盛装双氧水的化学仪器名称是__________。
(2)如何检验该套装置的气密性__________。
(3)相同浓度的过氧化氢,其分解速率随着二氧化锰用量的增加而___________。
(4)从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入_______g的二氧化锰为较佳选择。
(5)某同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越大,所需要的时间就越长,其反应速率越慢”的结论,你认为是否正确___________,理由是_________。(提示:H2O2的密度可认为近似相等)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某活动小组利用如图装置进行NO、NO2的性质实验,按下列步骤进行(装置气密性已检验完毕)。
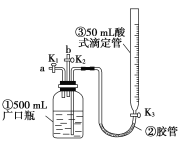
Ⅰ.向广口瓶①中通入NO并测定NO的体积
(1)通入NO前,向广口瓶①中加水的主要操作为____________________________。
(2)从导管a通入一定量的NO,并测得NO体积为V L(V<0 mL,气体体积已经换算为标准状况)。测定NO体积的主要操作为_______________________________。
Ⅱ.验证NO的还原性;探究工业生产硝酸的原理
(3)停止通入NO后关闭K1、K3;打开K2,从导管b缓缓通入O2,可观察到的现象是___________________________________________________________;
写出对应现象的化学方程式:________________________________。
(4)继续通入O2,打开K3,并及时调整酸式滴定管③中液面与广口瓶①中液面相平,直到广口瓶①中刚好充满液体。
①当通入氧气的体积为![]() 时,则广口瓶①的气体体积为________;
时,则广口瓶①的气体体积为________;
②当广口瓶①中刚好充满液体时,所得液体的物质的量浓度为_____mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com