
| A. | X元素的核外电子数为288 | |
| B. | 核素${\;}_{115}^{288}$X的质量数与中子数之差为173 | |
| C. | 113号元素属于非金属元素 | |
| D. | 115号元素的最高正化合价是+5 |
分析 A.电子数=质子数;
B.质子数=质量数-中子数;
C.112号元素为第七周期第ⅡB族元素,113号元素位于第ⅢA族;
D.113号元素为第七周期第IIIA族元素,则115号元素位于第ⅤA族.
解答 解:A.${\;}_{115}^{288}$X的质子数为115,电子数=质子数=115,故A错误;
B.${\;}_{115}^{288}$X的质量数为288,质子数为115,质子数=质量数-中子数,则质量数与中子数之差为115,故B错误;
C.112号元素为第七周期第ⅡB族元素,113号元素位于第ⅢA族,由同主族元素性质变化规律可知,属于金属元素,故C错误;
D.113号元素为第七周期第IIIA族元素,则115号元素位于第ⅤA族,其最高正价为+5,故D正确;
故选D.
点评 本题考查原子结构与元素的性质,把握元素周期表中现有元素及112号元素的位置为解答的关键,注意选项A为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
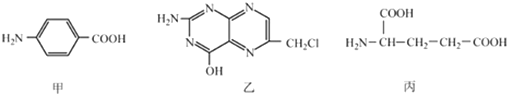
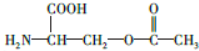 .
.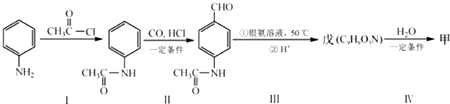
 +CO$→_{△}^{HCl}$
+CO$→_{△}^{HCl}$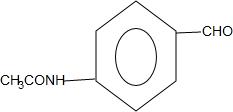 .
.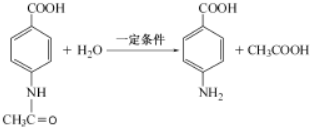 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45 mol•L-1 | B. | c(Z)=1.20 mol•L-1 | C. | c(W)=1.00 mol•L-1 | D. | c(W)=0.80 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将二氧化硫通入到 一定量氯水中 | 将氨水滴入到一定量 氯化铝溶液中 | 将铜粉加入到一定量 浓硝酸中 | 将铁粉加入到一定量氯化铁溶液中 |
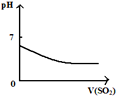 | 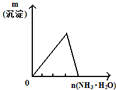 |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除②以外 | B. | 除④以外 | C. | 除⑤以外 | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
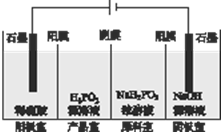 次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物光合作用:光能→生物质能 | B. | 太阳能热水器:太阳能→电能 | ||
| C. | 石灰石高温分解:热能→化学能 | D. | 铅蓄电池:化学能→电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
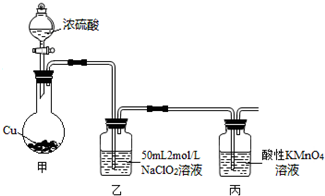
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
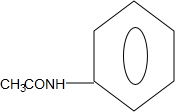
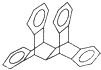 科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )
科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus--罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene.该有机物的结构简式如图所示,下列说法正确的是( )| A. | 该有机物属于苯的同系物 | |
| B. | 该有机物完全燃烧生成CO2和H2O的物质的量之比为15:11 | |
| C. | 该有机物的一氯代物只有4种 | |
| D. | 该有机物既能发生取代反应又能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com