
| A. | 标准状况下,11.2LC5H12含有的分子数为0.5NA | |
| B. | 21g乙烯与丁烯的混合气体中含有3NA个C-H键 | |
| C. | 1L0.1mol/LNH4NO3溶液中含有0.2NA个N | |
| D. | 光照下,1molCl2与足量CH4完全反应,生成NA个HCl |
分析 A.气体摩尔体积使用对象为气体;
B.乙烯和丁烯的最简式均为CH2;
C.1mol硝酸铵含有2mol氮原子;
D.氯气与甲烷发生取代反应,甲烷分子中取代1个氢原子生成1个氯化氢分子.
解答 解:A.标况下,戊烷为液体,不能使用气体摩尔体积,故A错误;
B.乙烯和丁烯的最简式均为CH2,故14g混合物中含有的CH2的物质的量n=$\frac{21g}{14g/mol}$=1.5mol,而1molCH2中含2molC-H键即2NA个,所以21g乙烯与丁烯的混合气体中含有3NA个C-H键,故B正确;
C.1L0.1mol/LNH4NO3溶液含有硝酸铵物质的量为0.1mol,含有0.2NA个N,故C正确;
D.氯气与甲烷发生取代反应,甲烷分子中取代1个氢原子生成1个氯化氢分子,则1molCl2与足量CH4完全反应,生成NA个HCl,故D正确;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算和应用,明确以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意烯烃的结构特点,甲烷与氯气发生取代反应原理,题目难度中等.


科目:高中化学 来源: 题型:实验题
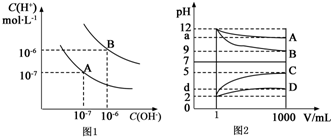
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cu2+、NO3-、SO42- | B. | K+、Na+、SO42-、Cl- | ||
| C. | CO32-、H+、Na+、K+ | D. | H+、Cl-、NO3-、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去NaCl溶液中少量CaCl2:加入适量K2CO3 | |
| B. | 用蒸馏的方法从海水中得到淡水 | |
| C. | 用酒精可以从碘水中萃取碘 | |
| D. | 用浓硫酸除去氨气中混有的水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
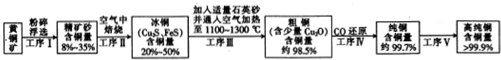
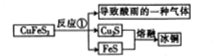
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com