
| A. | C6H12N4 | B. | C4H8N4 | C. | C6H10N4 | D. | C6H8N4 |
科目:高中化学 来源: 题型:解答题

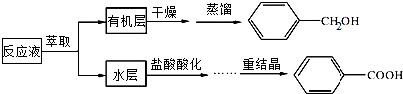

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法 | |
| B. | 乙炔、苯和乙苯的实验式相同 | |
| C. | 可用溴水鉴别乙醇、甲苯和溴苯 | |
| D. | 有机物 的系统命名为2-甲基-1,3-二丁烯 的系统命名为2-甲基-1,3-二丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质 | |
| B. | 所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质 | |
| C. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1 mol•L-1KNO3溶液中滴加稀盐酸使溶液的pH=5,此时混合液中c(K+)<c(NO3-) | |
| B. | 25℃时,0.1 mol•L-1氨水和0.05 mol•L-1氨水中c(OH-)之比是2:1 | |
| C. | 0.1 mol•L-1NH4Cl溶液中c(Cl-)=c(NH4+) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH使混合液pH=7,此时溶液中c(Na+)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②中红色褪去的原因是SO2将SCN-还原 | |
| B. | ①中红色褪去的原因是KMnO4将SCN-氧化 | |
| C. | ②中红色褪去的原因是SO2将Fe3+还原成Fe2+ | |
| D. | SCN-在适当条件下可失去电子被氧化为(SCN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
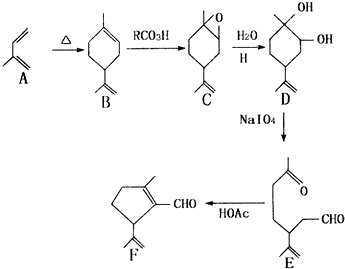

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | |
| B. | 将少量硝酸银溶液滴入氨水中:Ag++2NH3•H2O═[Ag(NH3)2]++2H2O | |
| C. | KAl(SO4)2中滴加Ba(OH)2使SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 铝粉与NaOH的溶液反应:2Al+2OH-═AlO2-+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com