
下列有关物质用途的说法错误的是
A. 氢氧化铁胶体可用于净水 B. Fe2O3可用作红色涂料
C. 纯碱溶液可用于去除油污 D. MnO2和浓HCl可用于工业制氯气
科目:高中化学 来源:2016-2017学年湖北省枣阳市高一下学期第一次质量检测化学试卷(解析版) 题型:选择题
在下列元素中,不属于主族元素的是
A. 铁 B. 钙 C. 氧 D. 溴
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省苏州市高一上学期期末考试化学试卷(解析版) 题型:填空题
写出下列反应的化学方程式。
(1)电解饱和食盐水:____________。
(2)氢氧化钠溶液腐蚀磨砂玻璃塞:____________。
(3)实验室用亚硫酸钠与浓硫酸反应制备二氧化硫:____________。
(4)氢氧化铝溶于氢氧化钠溶液:____________。
(5)氨在催化剂的作用下与氧气发生反应,生成一氧化氮____________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:填空题
NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其生产工艺如下:
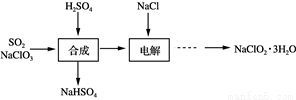
(1) “合成”步骤可以得到ClO2,其反应的化学方程式为_____________________________。
(2) “电解”步骤阳极会生成一种气体,其化学式为____________ 。
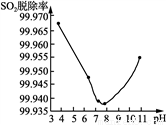
(3) 反应生成的ClO2可用于高效脱除烟气中的SO2。以ClO2脱除SO2实验时SO2脱除率与溶液pH关系如右图所示。pH在3~7.6之间时,随pH增大,ClO2氧化性减弱,脱硫率降低。而当pH>7.6时,随pH增大,SO2脱除率又升高,其原因可能为_____________________________________。
(4) 国家标准规定产品中优级纯试剂纯度≥99.8%,分析纯试剂纯度≥99.7%,化学纯试剂纯度≥99.5%。为了确定某批次NaClO2产品的等级,研究小组设计测定方案如下:取10.00 g样品,用适量蒸馏水溶解后,加入略过量的KI溶液;充分反应后,将反应液定容至200 mL,取出20.00 mL于锥形瓶;向锥形瓶中滴加两滴淀粉溶液,用2.00 mol·L-1的Na2S2O3溶液与之反应,消耗Na2S2O3溶液22.00 ml。该样品可达________试剂纯度。(写出计算过程)
已知:ClO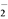 +4I-+4H+===2H2O+2I2+Cl-,I2+2S2O
+4I-+4H+===2H2O+2I2+Cl-,I2+2S2O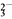 ===2I-+S4O
===2I-+S4O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A. 氧化铁与醋酸:Fe2O3+6H+===2Fe3++3H2O
B. 碳酸钠与盐酸:Na2CO3+2H+===2Na++CO2↑+H2O
C. 铁片插入到硫酸铜溶液中:2Fe+3Cu2+===2Fe3++3Cu
D. 向盐酸中加入适量氨水:H++NH3·H2O===NH +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:选择题
反应2CO2+6H2 CH2=CH2+4H2O可用于合成烯烃。下列有关说法错误的是
CH2=CH2+4H2O可用于合成烯烃。下列有关说法错误的是
A. 增大压强可加快该反应速率
B. 升高温度能加快该反应速率
C. 增大H2的浓度能加快该反应速率
D. 密闭容器中,通入略过量的CO2可以实现H2的100%转化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省扬州市高二第二次(3月)学业水平模拟测试化学试卷(解析版) 题型:选择题
紫水晶在西方国家代表着“爱的守护石”,其主要成分SiO2属于
A. 碱性氧化物 B. 酸性氧化物 C. 碱 D. 盐
查看答案和解析>>
科目:高中化学 来源:2017届江西省新余市高三下学期第七次模拟考试理综化学试卷(解析版) 题型:填空题
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
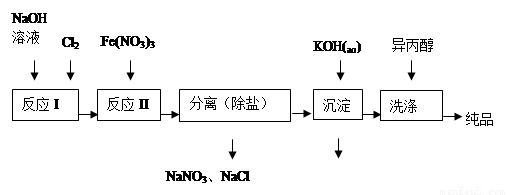
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应II的离子方程式为 。
③高铁酸钾在水中既能消毒杀菌,又能净水,是一种理想的水处理剂.它能消毒杀菌是因为 它能净水的原因是 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5mol/L,则需要调整 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(4)高铁电池是正在研制中的可充电干电池,高铁电池具有工作电压稳定, 放电时间长等优点,有人以高铁酸钾、二氧化硫和三氧化硫原料,以硫酸酸钾为电解质,用惰性电极设计成高温下使用的电池,写出该电池正极电极反应式: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省株洲市高一下学期第一次月考化学试卷(解析版) 题型:选择题
对于1LH2SO4和HNO3的混合溶液,若H2SO4和HNO3物质的量浓度存在如下关系:c(H2SO4)+c(HNO3)=1.2mol·L-1,则理论上最多能溶解铜的物质的量为
A. 0.80mol 0.72mol B. 0.45mol C. 0.40mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com