
【题目】2019年诺贝尔化学奖由来自美、英、日的三人分获,以表彰他们在锂离子电池研究方面做出的贡献,他们最早发明用LiCoO2作离子电池的正极,用聚乙炔作负极。回答下列问题:
(1)基态Co原子价电子排布图为______________(轨道表达式)。第四电离能I4(Co)比I4(Fe)小,是因为_____________________。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,其原因是_________________________.
(3)乙炔(C2H2)分子中δ键与π键的数目之比为_______________。
(4)锂离子电池的导电盐有LiBF4等,碳酸亚乙酯(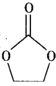 )是一种锂离子电池电解液的添加剂。
)是一种锂离子电池电解液的添加剂。
①LiBF4中阴离子的空间构型是___________;与该阴离子互为等电子体的分子有_____________。(列一种)
②碳酸亚乙酯分子中碳原子的杂化方式有_______________________。
(5)Li2S是目前正在开发的锂离子电池的新型固体电解质,其晶胞结构如图所示,已知晶胞参数a=588pm。
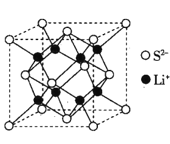
①S2-的配位数为______________。
②设NA为阿伏加德罗常数的值,Li2S的晶胞密度为____________(列出计算式)![]() 。
。
【答案】![]() Co失去的是3d6上的一个电子,而
Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8
需要的能量较高 LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小 3:2 正四面体 CF4 sp2、sp3 8 ![]()
【解析】
(1)基态Co原子价电子排布式为3d74s2,再得价电子排布图;Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此得到结论。
(2)LiCl与LiF都为离子晶体,主要比较离子晶体中离子半径,键能和晶格能。
(3)乙炔(C2H2)分子中碳碳三键,因此可得分子δ键与π键的数目之比。
(4)①先计算LiBF4中阴离子的电子对,再得空间构型,根据左右价电子联系得出与该阴离子互为等电子体的分子。
②分别分析碳酸亚乙酯分子中每个碳原子的δ键和孤对电子得到结论。
(5)①以最右面中心S2-分析,分析左右连接的锂离子个数。
②先计算晶胞中有几个硫化锂,再根据密度公式进行计算。
(1)基态Co原子价电子排布式为3d74s2,其价电子排布图为![]() ;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而
;第四电离能I4(Co)比I4(Fe)小,其Co3+为3d6,Fe3+为3d5,Fe3+半满,稳定,难失去电子,因此原因为Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高,故答案为:
需要的能量较高,故答案为:![]() ;Co失去的是3d6上的一个电子,而
;Co失去的是3d6上的一个电子,而![]() 失去的是半充满状态3d5上的一个电子,故
失去的是半充满状态3d5上的一个电子,故![]() 需要的能量较高。
需要的能量较高。
(2)LiCl的熔点(605℃)比LiF的熔点(848℃)低,它们都为离子晶体,离子晶体熔点主要比较半径,键能和晶格能,因此其原因是LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小,故答案为:LiCl和LiF均为离子晶体,Cl-半径比F-大,LiCl的晶格能比LiF的小。
(3)乙炔(C2H2)分子中碳碳三键,因此分子δ键与π键的数目之比为3:2,故答案为:3:2。
(4)①LiBF4中阴离子的电子对为![]() ,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
,因此空间构型是正四面体型;B-的价电子等于C的价电子,因此与该阴离子互为等电子体的分子有CF4,故答案为:正四面体;CF4。
②碳酸亚乙酯分子中碳氧双键的碳原子,δ键有3个,没有孤对电子,因此杂化方式为sp2,另外两个碳原子,δ键有4个,没有孤对电子,因此杂化方式为sp3,所以碳原子的杂化方式有sp2、sp3,故答案为:sp2、sp3。
(5)①以最右面中心S2-分析,连接左边有4个锂离子,右边的晶胞中也应该有4个锂离子,因此配位数为8,故答案为:8。
②设NA为阿伏加德罗常数的值,根据晶胞计算锂离子有8个,硫离子8个顶点算1个,6个面心算3个即总共4个,Li2S的晶胞密度 ,故答案为:
,故答案为:![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】经X射线研究证明PCl5在固态时,其空间构型分别是正四面体和正八面体的两种离子构成,下列关于PCl5的推断正确的是( )
A.PCl5晶体是分子晶体
B.PCl5晶体由[PCl3]2+和[PCl2]2-构成,且离子数目之比为1∶1
C.PCl5晶体由[PCl4]+和[PCl6]-构成,且离子数目之比为1∶1
D.PCl5晶体具有良好的导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大。其相关信息如下表所示:
X元素的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是其周期数的三倍 |
W原子的第一至第六电离能分别为:I1=578KJ·mol-1I2=1817KJ·mol-1I3=2745KJ·mol-1 I4=11575KJ·mol-1I5=14830KJ·mol-1I6=18376KJ·mol-1 |
Q为前四周期中电负性最小的元素 |
元素R位于周期表的第10列 |
回答下列问题:
(1)Y元素的基态原子中未成对电子数为______;X、Y、Z三种元素原子的第一电离能由小到大的顺序为____________(用元素符号表示)。
(2)W的氯化物的熔点比Q的氯化物的熔点__________(填“高”或“低”),理由是__________________________________________________。
(3)光谱证实元素W的单质与强碱性溶液反应有[W(OH)4]-生成,则[W(OH)4]-中存在(填字母)_____________。
a.极性共价键 b.非极性共价键 c.配位键 d.氢键
(4)含有X、R和镁三种元素的某种晶体具有超导性,其结构如下图所示。则该晶体的化学式为_______;晶体中每个镁原子周围距离最近的R原子有_______个。
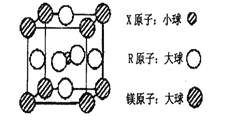
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g)![]() xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=____________
(2)从反应开始到10s,B的平均反应速率为____________
(3)从反应开始到40s达平衡状态,A的平均反应速率为____________
(4)平衡时容器中B的体积分数为____________
(5)下列各项能表示该反应达到平衡状态是____________
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量n(A)∶n(B)=2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将浓度均为0.5molL-1氨水和KOH溶液分别滴入到体积均为20mL且浓度相同的AlCl3溶液中,测得溶液的导电率与加入碱的体积关系如图所示,下列说法中错误的是( )
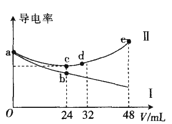
A.AlCl3溶液的物质的量浓度为0.2molL-1
B.根据图象可以确定导电率与离子种类有关
C.cd段发生的反应是Al(OH)3+OH-=AlO2-+2H2O
D.e点时溶液中的离子浓度:c(K+) =c(Cl-) +c(AlO2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华传统文化蕴含着很多科学知识,下列说法错误的是
A. “丹砂(HgS烧之成水银,积变又还成丹砂”描述的是可逆反应
B. “水声冰下咽,沙路雪中平”未涉及化学变化
C. “霾尘积聚难见路人”形容的霾尘中有气溶胶,具有丁达尔效应
D. “含浆似注甘露钵,好与文园止消渴”说明柑橘糖浆有甜味,可以止渴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚(结构简式如图所示》,是一种激素类药物。下列叙述正确的是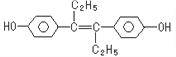
A. 己烯雌酚分子式为C18H12O2
B. 己烯雌酚与NaOH溶液、NaHCO3溶液均能反应
C. 1mol己烯雌酚最多能与4mol溴发生反应
D. 己烯雌酚可以发生加成反应,取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3:物质结构与性质]
金属材料在国民经济建设等领域具有重要应用,镁、镍、铜是几种重要的金属元素,请回答下列问题:
(1)镍元素的核电荷数为28,则原子基态电子排布式为 ________ ,结构中有 ___ 种不同形状的电子云。
(2)MgO的熔点高于CuO的原因是__________________________
(3)Mg元素的第一电离能反常地高于同周期后一种元素,原因是_____________________
(4)Ni与CO能形成配合物Ni(CO)4,该分子中σ键与π键个数比为 _____________________
(5)配合物[Cu(CH3C≡N)4]BF4中碳原子杂化轨道类型为______ ,BF4-的空间构型为_________________ 。
(6)铜与氧元素可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(1/2,1/2,1/2),则d的坐标参数为 ____________,已知该品体的密度为ρg/cm3,NA是阿伏加德罗常数值,则晶胞参数为 _______________ cm(列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com