
【化学-选修5有机化学基础】(15分)化合物H(C13H16O2)是一种香料,存在于金橘中,以烷烃A为原料合成H的路线如下:
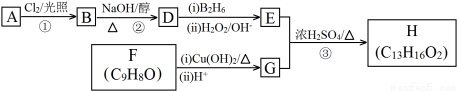
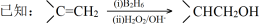
请回答:
(1)②的反应类型是 反应。
(2)H中的含氧官能团名称是 。
(3)F属于芳香族化合物,它的分子具有反式结构,则F的结构是 。
(4)B是A的一卤代物,经测定B分子中有3种不同化学环境的氢,则A的名称(系统命名)是 。
(5)③的化学方程式是 。
(6)芳香族化合物I是G的同分异构体,与G具有相同的官能团,则I的结构可能有 种(不包括顺反异构);其中苯环上的一氯代物有2种的I的结构简式是 。
科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:填空题
(14分)某课题小组合成一种复合材料的基体M的结构简式为: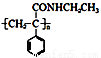
合成路线如下:
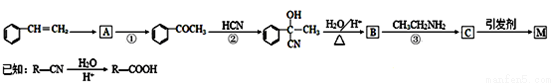
请回答下列问题:
(1)写出A的结构简式____。②的反应类型为____。
(2)B中含有的官能团有 。D的名称(系统命名)是 。
(3)写出反应⑤的化学方程式____。
(4)写出符合下列条件:①能使FeCl3溶液显紫色;②苯环只有二个取代基;③与新制的Cu(OH)2悬浊液混合加热,有砖红色沉淀生成;④苯环上一氯代物有2种同分异构体。写出有机物B的一种同分异构体的结构简式 。
(5)下列说法正确的是 。
a.E与分子式相同的醛互为同分异构体
b.F的分子式为C9Hl0NO
c.CH3CH2NH2能与盐酸反应
d.C分子中苯环上取代基含2个 健
健
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列各组原子序数表示的两种元素中,能够形成共价化合物的是
A.11与17 B.11与10 C.1与17 D.11与8
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
已知短周期元素的离子aA-、bB2-、cC+、dD2+都具有相同的电子层结构,则下列叙述正确的是
A.原子半径为D>C>A>B B.原子序数为a>b>c>d
C.离子半径为aA->bB2->cC+>dD2+ D.a+2=c
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省邛崃市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:选择题
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX >rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省八市高三教学质量监测考试理科综合化学试卷(解析版) 题型:填空题
选考【化学——选修3:物质结构与性质】(15分)四种常见元素的性质或结构信息如F表所示,请问答下列问题。
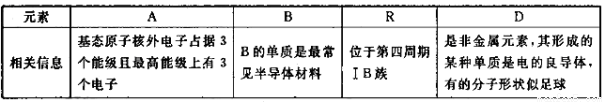
(1)R的基态原子价层电子排布式为________,这四种元素的第一电离能由大到小的顺序为________________(写元素符号)。
(2)A、B,D均可形成多种氢化物,在最常见的三种氢化物中,分子构型为三角锥的氢化物分子式为_______,任意写出一种中心原子存在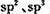 两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
两种杂化类型的物质的结构简式________,与A的常见单质互为等电子体的上述元素的氧化物是________。
(3)B、D均可形成氧化物,等物质的量的B、D的最高价氧化物中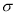 键之比为________,已知有下列两种数据:
键之比为________,已知有下列两种数据:

请解释键能大小与两种氧化物熔点、沸点高低差异过大的原因________。
(4)在一定条件下,Cl-与R2+可形成一种无限长链离子,研究表明该离子中每个氯原子最外层均达到8电子稳定结构,有些氧与R之间存在配位键,若该长链离子中含有n个R,则该离子的化学式为________。
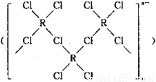
(5)A元素能形成组成为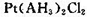 的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
的配合物,该配合物存在两种同分异构体:一种为淡黄色(Q),不具有抗癌作用,在水中的溶解度小;另一种为黄绿色(P),具有抗癌作用,在水中的溶解度较大。
①Q是________(填“极性”或“非极性”)分子,
②P的结构简式为________(AH3配体作为一个整体写)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列液体均处于25℃,有关叙述正确的是
A.某物质的溶液pH < 7,则该物质可能是酸或强酸弱碱盐
B.pH = 4的番茄汁中c(H+)是pH = 6的牛奶中c(H+)的20倍
C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同
D.pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+) = c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河北区高三总复习质量检测一化学试卷(解析版) 题型:填空题
(13分)研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:①Fe2O3(s) + 3C(石墨) = 2Fe(s) + 3CO(g) △H 1 = +489.0 kJ·mol-1
②C(石墨) +CO2(g) = 2CO(g) △H 2 = +172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
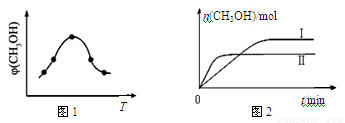
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”、“<”或“=”)。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其发生可逆反应的方程式为 。
②用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,请写出该电极反应的方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com