
��ѧ��Ӧ�����뷴Ӧ��Ũ�ȵĹ�ϵʽ(��Ϊ���ʷ���)��ͨ��ʵ��ⶨ�ģ��Է�ӦaA��Dd![]() eEΪ�������ȼ���÷�Ӧ�����ʷ���Ϊv��kcm(A)cn(D)��Ȼ��ͨ��ʵ���õ����ݣ����k��m��n��ֵ���ٽ�k��m��n��ֵ������ʽ���������ʷ��̣��ֲ��25��ʱ��Һ�еķ�Ӧ3X��2Y
eEΪ�������ȼ���÷�Ӧ�����ʷ���Ϊv��kcm(A)cn(D)��Ȼ��ͨ��ʵ���õ����ݣ����k��m��n��ֵ���ٽ�k��m��n��ֵ������ʽ���������ʷ��̣��ֲ��25��ʱ��Һ�еķ�Ӧ3X��2Y![]() 2Z�ڲ�ͬŨ��ʱ�ķ�Ӧ�������±���
2Z�ڲ�ͬŨ��ʱ�ķ�Ӧ�������±���
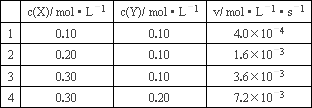
��������ʵ�����ݣ�����������⣺
(1)������Ӧ��25��ʱ�����ʷ���Ϊv��________��
(2)��c(X)��c(Y)��0.25 mol��L��1ʱ��v��________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijͬѧ�������ͼ��ʾװ�ã����ּг�װ������ȥ������ʵ���о���
ijͬѧ�������ͼ��ʾװ�ã����ּг�װ������ȥ������ʵ���о���| ��� | V��H2SO4��/mL | c��H2SO4��/mol?L-1 | t/s | �� | 40 | 1 | t1 | �� | 40 | 4 | t2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2- 8 |
- 3 |
2- 4 |
- 3 |
| ʵ���� | �� | �� | �� | �� | �� |
| c��I-��/mol?L | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c��S2O82-��/mol?L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ijͬѧ�������ͼ��ʾװ�ã����ּг�װ������ȥ������ʵ���о�����ش�
ijͬѧ�������ͼ��ʾװ�ã����ּг�װ������ȥ������ʵ���о�����ش�| ��� | V��H2SO4��/mL | C��H2SO4��/mol?L-1 | t/s |
| I | 40 | 1 | t1 |
| II | 40 | 4 | t2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(X)/ mol��L-1 | c(Y)/ mol��L-1 | v/ mol��L-1��s-1 |
1 | 0.10 | 0.10 | 4.0��10-4 |
2 | 0.20 | 0.10 | 1.6��10-3 |
3 | 0.30 | 0.10 | 3.6��10-3 |
4 | 0.30 | 0.20 | 7.2��10-3 |
��������ʵ�����ݣ�����������⣺
��1��������Ӧ��
��2����c(X)=c(Y)=0.25 mol��L-1ʱ��v=_______________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com