
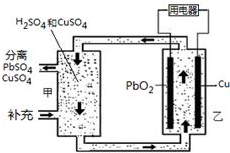
 流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )
流动电池可以在电池外部调节电解质溶液,从而维持电池内部电解质溶液浓度稳定,原理如图.下列说法错误的是( )| A. | Cu为负极 | |
| B. | PbO2电极的电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O | |
| C. | 甲中应补充硫酸 | |
| D. | 当消耗1 mol PbO2,需分离出2 mol CuSO4 |
分析 根据电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则铜失电子发生氧化反应为负极,反应式为:Cu-2e-═Cu2+,PbO2得电子发生还原反应为正极,反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,据此分析.
解答 解:A.根据电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则铜失电子发生氧化反应为负极,故A正确;
B.PbO2得电子发生还原反应为正极,反应式为:PbO2+4H++SO42-+2e-═PbSO4+2H2O,故B正确;
C.由电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,则调节电解质溶液的方法是补充H2SO4,故C正确;
D.电池总反应为Cu+PbO2+2H2SO4═CuSO4+PbSO4+2H2O,当消耗1 mol PbO2,需分离出1mol CuSO4,故D错误;
故选D.
点评 本题考查了化学电源新型电池,根据原电池原理来分析解答,知道电极上发生的反应即可解答,电极反应式的书写是学习难点,总结归纳书写规律,难度中等.


科目:高中化学 来源: 题型:解答题
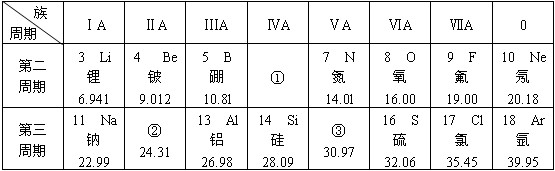
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
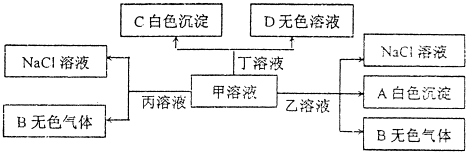
| A. | 乙为AlC13 | |
| B. | 能大量共存于溶液丙中的离子:Fe3+、SO42-、NO3- | |
| C. | 甲溶液中粒子的等量关系:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| D. | 甲溶液中滴加少量丁溶液反应的离子方程式:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂是天然高分子化合物 | |
| B. | 蔗糖和麦芽糖互为同分异构体 | |
| C. | 蛋白质溶液中加入Na2SO4可使其变性 | |
| D. | 苯酚、甲醛通过加聚反应可制得酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉、生石灰均可作食品抗氧化剂 | |
| B. | 明矾、氯化铁均可作净水剂 | |
| C. | 牛奶、鸡蛋清均可用于重金属中毒解毒 | |
| D. | 碘酒、双氧水均可用于伤口消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
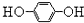 1,4一二羟基蒽醌结构简式
1,4一二羟基蒽醌结构简式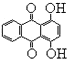
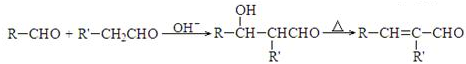
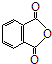 .
. .
.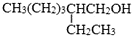 )反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线.
)反应可以制得另一种塑化剂DEHP.参照D的上述合成路线,设计一条由D为起始原料制备异辛醇的合成路线.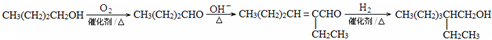 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
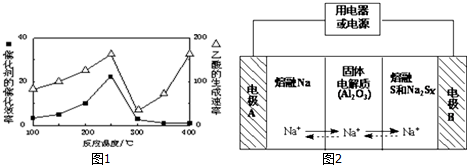
| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 碱性溶液中:NO3-、I-、Na+、Fe2+ | |
| D. | 将足量CO2通入时:H+、NH4+、Al3+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com