
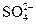 )=______________。
)=______________。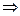 c混(H+)
c混(H+)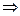 pH。
pH。 ="0.15" mol·L-1
="0.15" mol·L-1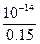 =6.67×10-14 mol·L-1,pH=14-lg6.67。
=6.67×10-14 mol·L-1,pH=14-lg6.67。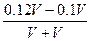 ="0.01" mol·L-1
="0.01" mol·L-1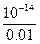 =10-12 mol·L-1,故pH=12
=10-12 mol·L-1,故pH=12 )="0.1" mol,稀释后:c(
)="0.1" mol,稀释后:c( )=
)=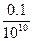 =10-11 mol·L-1,c(H+)=
=10-11 mol·L-1,c(H+)=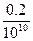 =2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。
=2×10-11 mol·L-1<10-7,酸稀释后不可能变成碱,故c(H+)≈10-7 mol·L-1。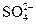 )=10-7∶10-12=105∶1。
)=10-7∶10-12=105∶1。

科目:高中化学 来源:不详 题型:单选题
| A.需要加热方能发生的反应一定是吸热反应 |
| B.放热的反应在常温下一定很容易发生 |
| C.放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 |
| D.吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶10∶100∶1000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.在A点:c(Na+)> c(OH—)> c(CH3COO—)> c(H+) |
| B.在A点:c(Na+)+ c(H+)==c(OH—)+c(CH3COO—) |
| C.在B点:c(CH3COO—)> c(Na+)> c(H+)= c(OH—) |
| D.在C点:c(CH3COO—)> c(Na+)> c(H+)> c(OH—) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若V1>V2,则说明HA的酸性比HB的酸性强 |
| B.若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C.因为两种酸溶液的pH相等,故V1一定等于V2 |
| D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com