
【题目】某实验室模拟以粗盐(含杂质Mg2+、Ca2+、K+和SO42-)为原料进行生产并综合利用的某过程如下图所示。已知: Kap[Mg(OH)2]=5.6×10-12;Kap[CaMg(CO3)2]<< Kap[Mg(OH)2]。

(1)过量试剂A是_________________________溶液。(填名称)
(2)图为KCI和NaCl的溶解度曲线,连续操作④是_____________________________。

(3)向滤液IV中通入NH3CO2气体后能够得到NaHCO3的原因是_______________(用必要的化学用语和文字说明)。
(4)已知碳酸的Ka2=5.6×10-11,次氯酸的Ka =3×10-8,工业上用饱和纯碱溶液代替烧碱溶液与Cl2反应生产有效成分为次氯酸钠的消毒液,反应的化学方程式是___________________________________。
(5)经检测,滤液Ⅲ中c(Mg2+)<1.0×10-7 mol/L,则镁元素最终沉淀物是_________________。
(6)⑤处母液可以生产氮肥NH4Cl,NH4Cl可用于制取具有漂白作用的三氯化氮。工业上制备NCl3的一种方法是用图所示装置电解,其原理是NH4Cl+2HCl![]() NC13十3H2↑。
NC13十3H2↑。

阳极反应式是___________________________________。
(7)电解氯化钠时需要加入一定量氯化钙,根据学习过的电解知识推测加入氯化钙的主要作用是_____________。
【答案】氯化钡 蒸发浓缩、结晶 ![]() ,生成的碳酸氢钠的溶解度小
,生成的碳酸氢钠的溶解度小 ![]()
![]()
![]() 降低电解质熔点
降低电解质熔点
【解析】
粗盐溶解后得到溶液I,加入过量氯化钡溶液,可除去硫酸根离子,再调节pH至11,除镁离子、钙离子,生成复盐![]() ,再蒸发浓缩、结晶分离NaCl和KCl。
,再蒸发浓缩、结晶分离NaCl和KCl。
(1)加入过量试剂A后产生硫酸钡沉淀,说明试剂A中含有钡离子,为了不引入杂质离子,故所加过量试剂A为氯化钡溶液;
(2)滤液III中含有NaCl、KCl、NaOH、Na2CO3,加入盐酸调pH=3~4,得到NaCl和KCl的混合液,在较高温度下NaCl的溶解度小,而KCl的溶解度大,加热蒸发,使NaCl析出;故答案为:蒸发浓缩、结晶;
(3)向滤液III中先通氨气,再通入二氧化碳;因为二氧化碳溶解度小,先通入氨气,提高滤液的pH,可促进二氧化碳的吸收,且碳酸氢钠的溶解度较小,故最终得到碳酸氢钠,发生的反应方程式为:![]() ;
;
故答案为:![]() ,生成的碳酸氢钠的溶解度小;
,生成的碳酸氢钠的溶解度小;
(4)![]() ,所以溶液中碳元素主要以HCO3-的形式存在,反应方程式为:
,所以溶液中碳元素主要以HCO3-的形式存在,反应方程式为:![]() ;
;
(5)经计算,若沉淀B为氢氧化镁,则pH=11的滤液III中![]() ,实际上
,实际上![]() ,所以沉淀B应该是复盐
,所以沉淀B应该是复盐![]() ;
;
(6)根据图示b极产生氢气,可以判断a极为阳极,b极为阴极;根据总反应方程式及溶液为酸性环境,可知阳极电极反应为![]() ;
;
(7)电解氯化钠时加入一定量氯化钙,形成低共熔物,降低了电解时所需的温度;


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.因为3O2![]() 2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B.太阳能、煤气、潮汐能是一次能源;电力、蒸汽、地热是二次能源
C.吸热反应就是反应物的总能量比生成物的总能量小的反应;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量少的反应
D.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=-566.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g) +4H2(g) ΔH=akJ/mol
CO(g) +2H2(g)=CH3OH(g) ΔH=bkJ/mol
试写出由CH4和O2制取甲醇蒸气的热化学方程式:____。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)![]() CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
CH3OH(g)。甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率v(H2)=_______。
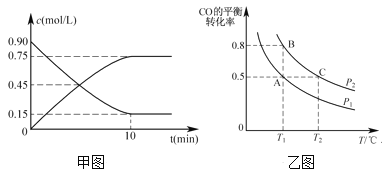
(3)在一容积可变的密闭容器中充入1 molCO和2mol H2,CO的平衡转化率随温度(T)、压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是____。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA___PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为2L。如果反应开始时仍充入1molCO和2molH2,则在平衡状态B时容器的体积V(B)=___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下表是A、B两种有机物的有关信息:
A | B |
①分子填充模型为: ②能使溴的四氯化碳溶液褪色; ③其产量是衡量石油化工水平的标志。 | ①由C、H、O三种元素组成,是厨房中的常见调味剂; ②水溶液能使紫色石蕊试液变红。 |
根据表中信息回答下列问题:
(1)关于A的下列说法中,不正确的是____(填标号)。
a.分子里含有碳碳双键 b.分子里所有的原子共平面 c.结构简式为CH2CH2
(2)A与氢气发生加成反应后生成物质C,与C在分子组成和结构上相似的有机物有一大类,它们的通式为CnH2n+2。当n=___时,这类有机物开始出现同分异构体。
(3)B与乙醇反应的化学方程式为___,反应类型为____。
Ⅱ.糖类、油脂和蛋白质是人体需要的重要营养素。
(4)下列说法正确的是____(填标号)。
a.糖类、油脂、蛋白质都是仅由C、H、O三种元素组成的
b.糖类、油脂、蛋白质都是高分子化合物
c.油脂有油和脂肪之分,都属于酯
(5)淀粉和纤维素的化学式都是(C6H10O5)n,它们____(填“是”或“不是”)同分异构体,淀粉水解的最终产物是____(写名称)。
(6)重金属盐能使人体中毒,这是由于它使人体内的蛋白质发生了____(填“盐析”或“变性”)作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确是( )
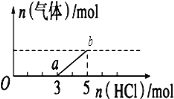
A.oa段反应的离子方程式为:H++OH-=H2O
B.O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C.标准状况下,通入CO2的体积为4.48L
D.原NaOH溶液的物质的量浓度为2.5molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)石灰法是目前应用最广泛的工业废气脱硫方法,过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,其产物可作建筑材料。有关反应的化学方程式____________,_____________,___________。
(2)汽车燃料中一般不含氮元素,尾气中所含的NO是如何产生的?说明原因并写出有关方程式___________________________________________________。
(3)治理汽车尾气中NO和CO的一种方法是,在汽车的排气管上装一个催化转化装置,使NO和CO反应,生成无毒的物质。反应的化学方程式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ||||||
4 | ⑧ | ⑨ | ||||||
请按要求回答下列问题。
(1)这九种元素中,原子半径最大的是(填元素符号)___;元素⑤的原子结构示意图为___。
(2)③、④、⑤三种元素中非金属性最强的元素是(填元素符号)___。
(3)元素⑤、⑦、⑨形成的气态氢化物稳定性最差的是(填写分子式)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.硅酸钠溶液与盐酸反应![]() +2HCl=2Cl-+ H2O+SiO2↓
+2HCl=2Cl-+ H2O+SiO2↓
B.水玻璃中通入过量二氧化碳![]() +CO2+H2O=
+CO2+H2O=![]() +H2SiO3↓
+H2SiO3↓
C.硅酸与氢氧化钠溶液反应H2SiO3+ OH-=![]() + H2O
+ H2O
D.SiO2与氢氧化钠溶液反应SiO2+2OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com