
【题目】某微粒A的结构示意图为![]()
(1)若A是原子,则A的元素符号为__;若A是带一个正电荷的阳离子,则X=___
(2)若X=8,则此阴离子与(1)中带一个正电荷的阳离子形成一种常见化合物的化学式是___,它是不是电解质(填是或否)____。写出此化合物与盐酸反应的化学方程式:________________________________
(3)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:___(填序号)
①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥NH4+
(4)若A的阳离子为An+且质量数为a,则其质子数为____________,中子数为_______________(用含有a,n的代数式表达)
【答案】![]() 11 Na2O 是 Na2O+2HCl=2NaCl+H2O ①③④⑥
11 Na2O 是 Na2O+2HCl=2NaCl+H2O ①③④⑥ ![]()
![]()
【解析】
(1)在原子中,核内质子数=核外电子数;阳离子,质子数=核外电子数+所带电荷数;
(2)当x=8时,核内质子数小于核外电子数,该粒子是氧离子,与钠离子形成一种常见化合物的化学式是Na2O;
(3)甲烷、氟化氢分子含有10个电子,铝离子、铵根离子含有10个电子;
(4)阳离子,质子数=核外电子数+所带电荷数,中子数=质量数-质子数。
(1)在原子中,核内质子数=核外电子数,当x=10时,该微粒是Ne原子;若A是带一个正电荷的阳离子,则核内质子数比核外电子数多1,即为11;
(2)当x=8时,核内质子数小于核外电子数,该粒子是氧离子,与钠离子形成一种常见化合物的化学式是Na2O,属于电解质,与盐酸反应的方程式为:Na2O+2HCl=2NaCl+H2O;
(3)甲烷、氟化氢分子含有10个电子,铝离子、铵根离子含有10个电子;
故答案为:①③④⑥;
(4)A的阳离子为An+且质量数为a,则其质子数为10+n,中子数为质量数-质子数=a-(10+n)。


科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
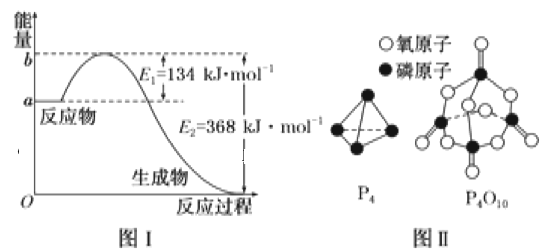
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是__(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=__kJ·mol-1。
(3)PCl5是一种重要的含磷化合物,在有机合成中用作氯化剂。某温度时,向2.0L恒温恒容密闭容器中充入1.0molPCl5,发生反应PCl5(g)![]() PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
反应在前50s的平均速率v(PCl5)=__。在该温度下,若起始时充入0.5molPCl5和amolCl2,平衡时PCl5的转化率仍为20%,则a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,将0.1mol/LNaOH溶液加入20mL0.1mol/LCH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是
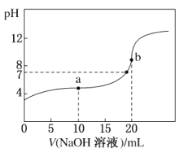
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下可实现下图所示物质之间的变化:
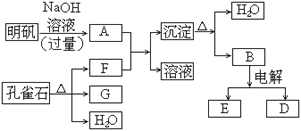
请填写以下空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。下图中的F是_____。
(2)写出明矾溶液与过量NaOH溶液反应的离子方程式:________。
(3)图中所得G和D都为固体,混和后在高温下可发生反应,写出该反应的化学方程式:____________。
(4)每生成1摩D,同时生成______摩E。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原油价格的下跌,加剧能源的过度开采,因此更要开展汽油的有机合成的研究。以下是一种合成汽油的路线:
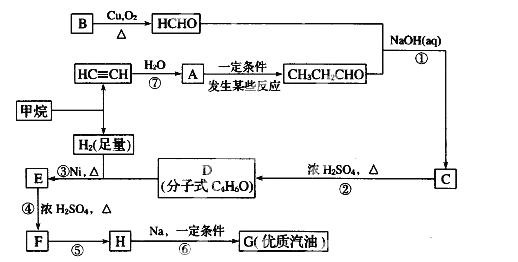
已知:R-CH2-CHO+R1-CH2-CHO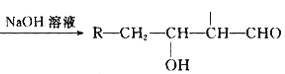
2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
CH3-CH=CH2+H-Cl
请根据以上信息回答下列问题:
(1)在反应①—⑥中,属于加成反应的是_________,B的分子式为 ________。
(2)A中官能团名称为_________, E的名称为 ____________。
(3)写出下列反应方程式:E→F_____________________H→G_________________。
(4)H也能与NaOH溶液反应,其反应方程式为:_________________________。
(5)D的核磁共振氢谱有____组吸收峰。写出符合下列条件D的所有同分异构体___________。
①链状结构,②能与钠反应生成气体,③不饱和碳上不与含氧官能团直接相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示原子:
表示原子:
(1)中性原子的中子数:N=________。
(2)阳离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(3)阴离子的中子数:![]() 共有x个电子,则N=________。
共有x个电子,则N=________。
(4)中性分子或原子团的中子数:![]() 分子中,N=________。
分子中,N=________。
(5)A2-原子核内有x个中子,其质量数为m,则ng A2-所含电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】方铅矿(PbS)与黄铁矿(FeS2)两矿法酸溶铅的示意图如下,下列说法错误的是( )
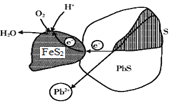
A.PbS上的电势比FeS2上的低
B.浸取液的pH随反应的进行逐渐增大
C.PbS表面发生的反应为PbS-2e-=Pb2++ S
D.FeS2表面发生的反应为FeS2+2e-=Fe2++ 2S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
①质子数相同的微粒一定属于同一种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
④某种元素的相对原子质量取整数,就是其质量数
⑤一种元素只能有一种质量数
⑥电子数相同的微粒不一定是同一种元素。
A.②③⑤⑥B.①②④⑤C.①②⑤⑥D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如图。下列相关分析正确的是( )

A.步骤①所加试剂可以是浓KOH溶液
B.可以用湿润的蓝色石蕊试纸检验生成的无色气体
C.步骤②的反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑
D.检验Fe3+的离子反应方程式为Fe3++3SCN-=Fe(SCN)3↓(血红色)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com