
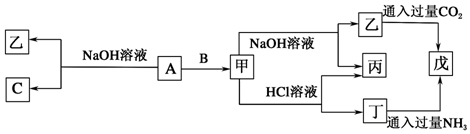
分析 甲既能与酸反应又能与碱反应,应为Al2O3或Al(OH)3,甲由单质A和B反应生成,应为Al2O3,且A能与NaOH反应,则A为Al,B为O2,C为H2,乙为NaAlO2,丁为AlCl3,丙为H2O,戊为Al(OH)3,结合物质的性质解答该题.
解答 解:(1)由上述分析可知,A为Al,甲为,乙为NaAlO2,丁为AlCl3,故答案为:Al; Al2O3; NaAlO2; AlCl3;
(2)A与NaOH溶液反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
乙与过量CO2反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3+HCO3-,
丁生成戊的离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+CO2+2H2O=Al(OH)3+HCO3-;Al3++3NH3.H2O=Al(OH)3↓+3NH4+.
点评 本题考查无机物的推断,为高频考点,把握Al及其化合物的性质、两性的应用为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:解答题

| Fe3 | Fe2+ | Cu2+ | Al3+ | |
| 开始沉淀时的 pH | 2.2 | 7.5 | 5.2 | 3.7 |
| 完全沉淀时的 pH | 3.2 | 9.0 | 6.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH与  组成元素相同,含有的电子数也相同 组成元素相同,含有的电子数也相同 | |
| B. | 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷 的名称是2,3,4-三甲基-2-乙基戊烷 | |
| C. | 丙烷分子的球棍模型示意图: | |
| D. | 乙炔的最简式:CH≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO | B. | Cu20 | C. | Cu | D. | Cu(OH)2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.01mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )| A. | 右边电极上生成物质的质量:①=② | |
| B. | 两级上产生气体的体积:①<② | |
| C. | 溶液的pH变化:①增大,②不变 | |
| D. | 电极反应式:①中阳极2H2O-4e-=4H++O2↑②中负极2H+-2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.
.检验该离子常用KSCN溶液.丙的外围电子排布式为3d104s1,在元素周期表中的位置为第四周期ⅠB族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 将稀硫酸改用浓硫酸 | B. | 向稀硫酸中加入少量硫酸铜溶液 | ||
| C. | 向稀硫酸中加入硫酸钠固体 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com