
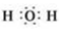 .
.分析 (1)据题意分析KCN和O2和H2O反应生成KHCO3和NH3;在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂,还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物;
(2)短周期元素为元素周期表中前三个周期,故KCN中短周期元素为C和N,C和N位于元素周期表同一周期,越往左半径越小;不同的电子具有不同的能量,故有不同的运动状态进行分析;水是由O-H键构成的共价化合物,分子式为H2O,据此分析;
(3)据在元素周期表中越往右越往上非金属性越强分析,注意书写时满足元素守恒和原子守恒;
(4)等物质的量浓度K2CO3、KCN、KHCO3溶液中,溶液均呈碱性且pH依次减小,故CO32-的水解程度大于CN-大于HCO3-水解程度,据此进行分析;
(5)据题目给的方程式分析优缺点.
解答 解:(1)由题意分析得,KCN和O2和H2O反应生成KHCO3和NH3,故方程式为2KCN+O2+4H2O$\stackrel{微生物}{→}$2KHCO3+2NH3;该反应中O元素化合价由0价变为-2价,所以O2 是氧化剂,得到的-2价的HNO3和H2O是还原产物,
故答案为:2KCN+O2+4H2O$\stackrel{微生物}{→}$2KHCO3+2NH3;HNO3、H2O;
(2)短周期元素为元素周期表中前三个周期,故KCN中短周期元素为C和N,C和N位于元素周期表同一周期,越往左半径越小,且C在N的右边,故C的半径大;不同的电子具有不同的能量,故有不同的运动状态,最外层的电子排布式是2S22P3,故最外层电子的运动状态有5种;水是由O-H键构成的共价化合物,分子式为H2O,故水的电子式是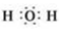 ;
;
故答案为:C;5;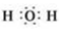 ;
;
(3)在元素周期表中越往右越往上非金属性越强,N在C的右边,故N的非金属性强,氧化性的制氧化性弱的,故符合的方程式为NaHCO3+HNO3=NaNO3+CO2↑+H2O;
故答案为:NaHCO3+HNO3=NaNO3+CO2↑+H2O;
(4)等物质的量浓度K2CO3、KCN、KHCO3溶液中,溶液均呈碱性且pH依次减小,故CO32-的水解程度大于CN-大于HCO3-水解程度,故溶液中阴离子浓度c(HCO3-)>c(CN-)>c(CO32-),
故答案为:c(HCO3-)>c(CN-)>c(CO32-);
(5)由题意得,微生物处理法的优点与缺点是,优点:不存在液氯泄漏等;缺点:微生物适应性差等,
故答案为:不存在液氯泄漏;微生物适应性差.
点评 本题考查化学方程式的书写,氧化还原反应中还原产物的判断,原子半径的比较,强碱弱酸盐由于发生水解,离子浓度的比较,本题难度中等.


科目:高中化学 来源: 题型:解答题
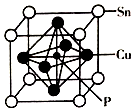 磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.
磷化铜(Cu3P2)用于制造磷青铜、磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①、③无支链,且分子中碳原子共直线 | B. | 沸点比较:⑤>④>③>②>① | ||
| C. | ①、②、③互为同系物 | D. | ③、④、⑤互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水溶液中:H+、I-、NO3-、SiO32- | |
| B. | 饱和氯水中:Cl-、NO3-、Na+、SO32- | |
| C. | 饱和CO2溶液中:H+、NH4+、Al3+、SO42- | |
| D. | 加入金属铝产生H2的溶液中:NH4+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝基苯(硝酸) NaOH溶液 分液 | |
| B. | 乙烯(二氧化硫) 酸性高锰酸钾 洗气 | |
| C. | 乙酸乙酯(乙酸) NaOH溶液 蒸馏 | |
| D. | 苯(苯酚) 溴水 过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com