



 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:
| A、密度之比为14:15 |
| B、体积相等时具有的电子数相等 |
| C、原子数相等时具有的中子数相等 |
| D、质量相等时具有的质子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同
某金属(A)在TK以下晶体的基本结构单元如图1所示,T K以上转变为图2所示结构的基本结构单元,在两种晶体中最邻近的A原子间距离相同| 金属 | 相对原子质量 | 分区 | 原子半径/pm | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | s区 | 186 | 0.960 | 108.4 |
| A | 60.20 | d区 | r | 7.407 | 7735 |
| 3 |
| 200 |
| 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:
莽草酸是合成治疗禽流感的药物--达菲(Tamiflu)的原料之一.莽草酸是A的一种异构体.A的结构简式如图1所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 操 作 | 现 象 |
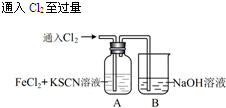 |
I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
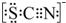 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g)
煤化工产业的重要产品之一甲醇,是一种新型的汽车动力燃料,发达国家等一般通过CO和H2化合制备甲醇(反应恒温恒容),该反应的化学方程式为:CO (g)+2H2(g)?CH3OH(g) | 时间/浓度 | c(CO)(mol/L) | c(H2)(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2+2NaOH=Cu(OH)2↓+2NaCl Cu2++2OH-=Cu(OH)2↓ |
| B、BaCO3+2HCl=BaCl2+CO2↑+H2O CO32-+2H+=CO2↑+H2O |
| C、Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3 Ca2++CO32-=CaCO3↓ |
| D、2KOH+H2SO4=K2SO4+2H2O H++OH-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH2═CH2+H2
| |||
B、 +HNO3 +HNO3
| |||
C、CH3CH2OH+CH3COOH
| |||
D、CH4+Cl2
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com