
【题目】锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素,在元素周期表中与钙和钡属于第ⅡA族元素。
(1)碱性:Sr(OH)2___Ba(OH)2(填“<”或“>”;锶的化学性质与钙和钡类似,用原子结构的观点解释其原因是___。
(2)碳酸锶是最重要的锶化合物。用含SrSO4和少量BaSO4、BaCO3、FeO、Fe2O3、Al2O3、SiO2的天青石制备SrCO3,工艺流程如下(部分操作和条件略):
Ⅰ.将天青石矿粉和碳酸钠溶液混合后充分反应,过滤;
Ⅱ.向滤渣中加入足量盐酸充分反应,过滤;
Ⅲ.向Ⅱ所得滤液中加入足量的稀硫酸,过滤;
Ⅳ.向Ⅲ所得滤液中先加入氯水,充分反应后再用氨水调pH约为7,过滤;
Ⅴ.向Ⅳ所得滤液中加入稍过量的碳酸氢铵溶液,充分反应后过滤,将沉淀洗净,烘干,得SrSO3。
已知:ⅰ.相同温度时溶解度:BaSO4<SrCO3<SrSO4<CaSO4
ⅱ.生成氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.0 | 3.4 |
完全沉淀的pH | 3.2 | 9.0 | 4.7 |
①步骤Ⅰ中,反应的化学方程式是______。为提高此步骤中锶的转化效果可以采取的措施有(任答两点即可):______。
②步骤Ⅱ中,能与盐酸反应而溶解的物质有______。
③步骤Ⅳ的目的是_______。
④下列关于该工艺流程的说法正确的是________(填字母代号)。
a.该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-
b.SiO2在步骤Ⅰ操作时被过滤除去
c.步骤Ⅴ中反应时,加入NaOH溶液可以提高NH4HCO3的利用率
【答案】< 同一主族元素,原子最外层电子数相同 SrSO4+Na2CO3=SrCO3+Na2SO4 增加碳酸钠溶液的浓度,搅拌 SrCO3、BaCO3、FeO、Fe2O3、Al2O3 将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全 ac
【解析】
(1)同主族,最外层电子数相同,性质相似,从上到下金属性增强;
(2)①SrSO4与碳酸钠溶液反应,沉淀转化的实质是溶解平衡的移动,将天青石粉末与碳酸钠溶液的混合物在90℃时加热1~2 h,经过滤、洗涤,得到碳酸锶,说明碳酸锶的溶解度小于硫酸锶的溶解度;
②SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应;
③先加入次氯酸,氧化亚铁离子,再用氨水调pH约为7,使铁离子、铝离子转化为沉淀。
(1)金属性Sr<Ba,则碱性:Sr(OH)2<Ba(OH)2,锶的化学性质与钙和钡类似,是因同一主族元素,原子最外层电子数相同;
(2)①I中只有SrSO4与碳酸钠溶液反应,反应为SrSO4+Na2CO3![]() SrCO3+Na2SO4,增加碳酸钠溶液的浓度,平衡正向进行,在反应过程中不断搅拌可以提高反应的速率和效率;
SrCO3+Na2SO4,增加碳酸钠溶液的浓度,平衡正向进行,在反应过程中不断搅拌可以提高反应的速率和效率;
②由物质的溶解性可知,只有碳酸盐和金属氧化物与盐酸反应,则SrCO3、BaCO3、FeO、Fe2O3、Al2O3均与盐酸反应;
③由生成氢氧化物沉淀的pH可知,Ⅳ的目的是将Fe2+氧化为Fe3+,使Fe3+和Al3+沉淀完全;
④a.分析过程可知该工艺产生的废液含较多的NH4+、Na+、SO42-、Cl-,a正确;
b.I.将天青石矿粉和碳酸钠溶液混合后充分反应,发生反应SrSO4+Na2CO3![]() SrCO3+Na2SO4,过滤不能除去不溶性SiO2,II.向滤渣中加入足量盐酸充分反应,过滤,SiO2不溶于盐酸,过滤除去,b错误;
SrCO3+Na2SO4,过滤不能除去不溶性SiO2,II.向滤渣中加入足量盐酸充分反应,过滤,SiO2不溶于盐酸,过滤除去,b错误;
c.此时Sr(OH)2与NH4HCO3反应时会有一个副反应:生成的NH3·H2O与NH4HCO3的反应,浪费了一部分NH4HCO3,如果加入溶液不会影响反应过程,但是会稀释NH3·H2O的浓度,使得副反应更慢、占的比例更少,也就是提高了NH4HCO3的利用率,c正确;
故合理选项是ac。


科目:高中化学 来源: 题型:
【题目】在25℃时,向20.00 mL 0.100 0 mol·L1 CH3COOH中滴加0.100 0 mol·L-1 NaOH过程中,pH变化如图所示。
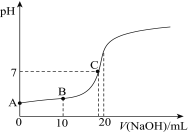
(1)A点溶液pH > 1,用电离方程式解释原因:___________________。
(2)下列有关B点溶液的说法正确的是_______(填字母序号)。
a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO-) + c(OH)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO-)
d.微粒浓度满足:2c(H+) + c(CH3COO-) =2c(OH-) +c(CH3COOH)
(3)C点溶液中离子浓度的大小顺序:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以二氧化锰为原料制取高锰酸钾晶体的实验流程如下:

下列说法正确的是
A. “灼烧”可在石英坩埚中进行
B. 母液中的溶质是K2CO3、KHCO3、KCl
C. “结晶”环节采用加热蒸发结晶的方法
D. “转化”反应中,生成的KMnO4和MnO2的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天青石(主要含有SrSO4和少量CaCO3杂质)是获取锶元素的各种化合物的主要原料。回答下列问题(相关数据如下):
温度/℃ | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
Sr(OH)2 | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
ⅡA元素氢氧化物 | Be(OH)2 | Mg(OH)2 | Ca(OH)2 | Sr(OH)2 | Ba(OH)2 | ||||
25℃时饱和溶液浓度molL-1 | 8.00×10-6 | 5.00×10-4 | 2.00×10-2 | 6.00×10-2 | 2.00×10-1 | ||||
I.(1)SrO2中氧元素的化合价为___。Sr(OH)2的碱性比Mg(
(2)工业上可以用SrO与铝粉充分混合,在真空加热反应生成金属锶和3SrO8Al2O3,写出该反应的化学方程式___。
Ⅱ.以天青石(主要含有SrSO4和少量CaCO3杂质)生产Sr(OH)2xH2O的工艺如下:
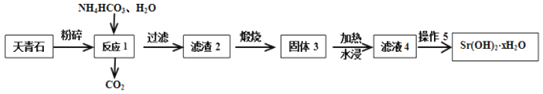
(3)滤渣2为混有CaCO3的SrCO3,写出生成SrCO3的化学方程式___。
(4)加热水浸固体3是为了获得较为纯净的Sr(OH)2涪液,此时应缓慢加热使沉淀颗粒长大,有利于___。
(5)从趁热过滤后的滤液中得到Sr(OH)2xH2O产品的步骤为降温结晶、过滤、洗涤、干燥。为得到较大颗粒的Sr(OH)2xH2O晶体,可采用的方法是___(填一种)。
(6)取m g纯净Sr(OH)2xH2O产品溶于水,加入过量纯碱溶液后过滤、洗涤、干燥后,得到n g滤渣,则x=___(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行第二组实验。实验过程中,观察到与第一组实验不同的现象:两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。 查阅资料得知,高铁酸根离子(FeO42—)在溶液中呈紫红色。

(1)电解过程中,X 极区溶液的 pH__(填“增大”“减小”或“不变”)。
(2)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣=FeO42—+4H2O 若在 X 极收集到672 mL 气体,在 Y 极收集到 168 mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁电极)质量减少__g。
(3)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由b点到c点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同体积、相同pH的氨水和氢氧化钠溶液加水稀释时的pH变化曲线如图所示,下列判断正确的是
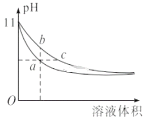
A. a点导电能力比b点强
B. a、c两点的c(H+)相等
C. 与盐酸完全反应时,消耗盐酸体积Va>Vc
D. b点的Kw值大于c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向饱和氯水中逐滴滴入![]() 的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是
的氢氧化钠溶液,pH变化如图所示,下列有关叙述正确的是![]()

A.①点所示溶液中只存在HClO的电离平衡
B.②到③的过程中水的电离程度一定减少
C.②点处表示氯气与氢氧化钠溶液恰好反应完全
D.②点所示溶液中:![]()
![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是草酸溶液中![]() 、
、![]() 三种微粒的分布分数
三种微粒的分布分数![]() 某微粒物质的量浓度与三种微粒物质的量被度和的比值
某微粒物质的量浓度与三种微粒物质的量被度和的比值![]() 与pH的关系图,下到有关说法不正确的是
与pH的关系图,下到有关说法不正确的是![]()
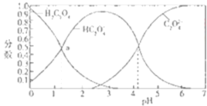
A.![]() 的溶液中
的溶液中![]()
B.![]() 溶液中:
溶液中:![]()
C.向![]() 溶液中加强酸至pH与a点对应时,溶液中
溶液中加强酸至pH与a点对应时,溶液中![]()
D.为使溶液中![]() 尽可能多一些,溶液的pH最好控制在
尽可能多一些,溶液的pH最好控制在![]() 左右
左右
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com