
| A. | 氯气使品红溶液褪色 | |
| B. | NO2 通入水中,气体由红棕色逐渐转变为无色 | |
| C. | 将铁片放入CuSO4溶液中,铁片表面有红色物质出现 | |
| D. | 向硅酸钠溶液中滴加适量的稀盐酸,有透明的凝胶形成 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
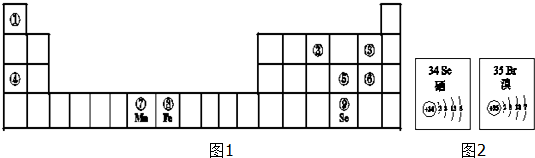
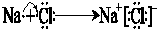 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氯是混合物,氯水是纯净物 | |
| B. | 金属钠着火燃烧时,用泡沫灭火器灭火 | |
| C. | 铝比铁活泼,所以铝比铁更容易被腐蚀 | |
| D. | CO2通入可溶性硅酸盐中析出硅酸胶体,所以硅酸的酸性小于碳酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 金属及其化合物在人类生活、生产中发挥着重要的作用.
金属及其化合物在人类生活、生产中发挥着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 3:1 | C. | 4:1 | D. | 5:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com