
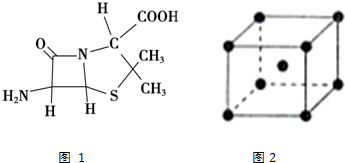
分析 (1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理书写其基态价电子排布式;
(2)根据价层电子对互斥理论确定离子空间构型,原子个数相等价电子数相等的微粒是等电子体,正负电荷重心重合的分子是非极性分子;
(3)根据价层电子对互斥理论确定碳原子杂化方式;
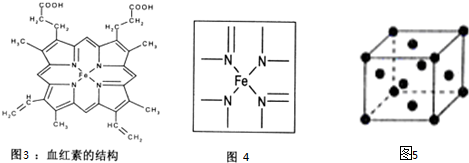
(4)利用均摊法计算晶体中Fe原子数目,根据原子半径计算原子的体积,根据晶胞的边长计算晶胞体积,晶胞的空间利用率=$\frac{晶胞中Fe原子总体积}{晶胞体积}$×100%;
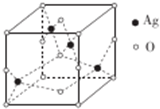
(5)元素的非金属性越强,其电负性越强;根据每个N原子含有的σ 键个数与孤电子对数之和判断其杂化方式;
(6)从图可以看出,晶胞中C60数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,晶胞有8个顶点,则可以形成8个四面体空隙,即可以填充8个K,据此计算.
解答 解:(1)铁是26号元素,基态原子核外有26个电子,3d、4s能级上电子是其价电子,根据构造原理知其价电子排布式为:3d64s2,
故答案为:3d64s2;
(2)NO3-中N原子价层电子对=3+$\frac{1}{2}$(5+1-3×2)=3,且不含孤电子对,所以是平面三角形结构,与N03-互为等电子体的一种非极性分子有:BF3[SO3( g)、BBr3等],
故答案为:平面正三角形;BF3;
(3)只要共价单键和孤电子对的和是4的原子就采取sp3杂化,根据图片知,采用sp3杂化的原子有C、N、O、S,故答案为:C、N、O、S;
(4)晶胞为体心立方(堆积),体心立方中含有原子数为1+8×$\frac{1}{8}$=2;晶胞中铁原子的体积为:2×$\frac{4}{3}$×π×r3,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为:$\frac{4}{\sqrt{3}}$r=$\frac{4\sqrt{3}}{3}$r,晶胞体积为:($\frac{4\sqrt{3}}{3}$)3,空间利用率为:$\frac{2×\frac{4}{3}×π×{r}^{3}}{({\frac{4\sqrt{3}}{3})}^{3}}$×100%;
故答案为:$\frac{2×\frac{4}{3}×π×{r}^{3}}{({\frac{4\sqrt{3}}{3})}^{3}}$×100%;
(5)元素的非金属性越强,其电负性越强,则有电负性C<O<N,H的电负性最小,所以电负性:H<C<N<O;血红素中N原子有的含有3个σ 键和一个孤电子对,属于sp3杂化;有的含有3个σ 键,属于sp2 杂化方式;
故答案为:H<C<N<O;sp2和sp3;
(6)从图可以看出,晶胞中C60数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,晶胞有8个顶点,则可以形成8个四面体空隙,即可以填充8个K,则K、C60的数目之比=8:4=2:1,故填充K后所得化合物为K2C60,
故答案为:K2C60.
点评 本题是对物质结构的考查,涉及核外电子排布规律、分子结构与性质、杂化轨道、晶胞计算、空间利用率的计算等,需要学生具有一定的空间想象与数学计算能力,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 盛装待测液的锥形瓶用蒸馏水洗过,没用待测液润洗 | |
| B. | 酸式滴定管在使用前未用待测液盐酸润洗 | |
| C. | 滴定前碱式滴定管尖嘴中有气泡,滴定后气泡消失 | |
| D. | 滴定前读数平视,滴定终点读数时俯视碱式滴定管的刻度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
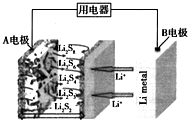
| A. | B电极为正极 | |
| B. | A电极上的电极反应式为:2Li++S8+2e-═Li2S8 | |
| C. | 每生成1molLi2S8转移0.25 mol电子 | |
| D. | 给该电池充电时,A电极连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 104 | 66 |
| 主要化合价 | +2 | +3 | +6、+4、-2 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW3 | |
| C. | Y的氧化物对应的水化物一种是强酸 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com