
【题目】I.有甲、乙、丙三种物质:
甲![]() 乙
乙 ![]()
分子式 | C9H8O |
部分性质 | 能使Br2/CCl4褪色 |
丙
(1)乙中含有的官能团的名称为_______________;
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
![]()
其中反应II的条件是___,反应III的化学方程式为______(不需注明反应条件);
(3)由甲出发合成丙的路线之一如下:

(a)写出反应③化学方程式________;
(b)丙的结构简式为_______________;
(c)D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式_______。
a.苯环上的一氯代物有两种
b.在空气中易被氧化,遇FeCl3溶液显紫色
c.能与Br2/CCl4发生加成反应
【答案】氯原子、 羟基 NaOH溶液,加热 ![]()

![]()
![]() 、
、![]() 、
、![]() (任写一种)
(任写一种)
【解析】
有机物结构改变、组成变化、反应条件等,是进行推断的重要依据;根据合成反应流程方向顺展逆推,是进行推断的重要方法。
(1)乙中含有的官能团为氯原子、羟基。
(2)图中,甲经三步转化为乙:第I步,甲侧链甲基上的氢被氯原子代替,是甲与氯气光照时的取代反应;碳碳双键与水的加成反应较难进行,故第II步为卤代烃在NaOH溶液中加热,发生水解反应生成![]() ;第III步为碳碳双键与HCl的加成反应,化学方程式为
;第III步为碳碳双键与HCl的加成反应,化学方程式为![]() 。
。
(3)由甲合成丙的路线中,反应①:甲与Br2加成生成A( );反应②:A在NaOH溶液中水解生成B(
);反应②:A在NaOH溶液中水解生成B( );反应③:B催化氧化生成C(
);反应③:B催化氧化生成C( ),则(a)反应③化学方程式
),则(a)反应③化学方程式 ;反应⑤:C与浓硫酸共热脱“H2O”生成丙,得(b)丙的结构简式为
;反应⑤:C与浓硫酸共热脱“H2O”生成丙,得(b)丙的结构简式为![]() 。
。
(c)苯环上的一氯代物有两种,可能是苯环邻位有两个相同的取代基,或对位有两个不同的取代基;在空气中易被氧化、遇FeCl3溶液显紫色,则有酚羟基;根据分子式C9H10O,得可能结构为![]() ;能与Br2/CCl4发生加成反应,-C3H5含碳碳双键。综上,D的符合题意的同分异构体有
;能与Br2/CCl4发生加成反应,-C3H5含碳碳双键。综上,D的符合题意的同分异构体有![]() 、
、![]() 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】按要求写出下列化学方程式或离子方程式:
(1)硫酸酸化的高锰酸钾与草酸反应的化学方程式:_____________________________。
(2)硫代硫酸钠与稀硫酸反应的化学方程式:____________________________________。
(3)硫酸酸化的碘化钾溶液与氧气反应的离子方程式:________________________。
(4)K2Cr2O7的溶液中K2Cr2O7与K2CrO4转化的离子方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)一定量的浓硝酸与足量铜完全反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积的O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol.L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50mL,下列说法正确的是
A. 参加反应的硝酸是0.4mol B. 消耗氧气的体积为1.68L
C. 混合气体中含NO2 1.12L D. 此反应过程中转移的电子为0.3mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某温度时,在一个10L恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示。根据图中数据填空:

(1)该反应的化学方程式为_________________。
(2)反应开始至2min,以气体X表示的平均反应速率为________________。
(3)平衡时容器内气体的压强与起始时比________________(填“变大”,“变小”或“相等”下同),混合气体的密度与起始时比________________。
(4)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=____。
Ⅱ.在恒温恒压的密闭容器中,当下列物理量不再发生交化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤各反应物或生成物的反应速率之比等于化学计量数之比
(1)一定能证明2NO2(g)![]() N2O4(g)达到平衡状态的是________(填序号,下同)。
N2O4(g)达到平衡状态的是________(填序号,下同)。
(2)一定能证明NH2COONH4(s)![]() CO2(g)+2NH3(g)达到平衡状态的是______。
CO2(g)+2NH3(g)达到平衡状态的是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚碳酸酯 的透光性良好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等,原来合成碳酸酯的一种原料是用有毒的光气,现在改用绿色化学原料碳酸二甲酯
的透光性良好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等,原来合成碳酸酯的一种原料是用有毒的光气,现在改用绿色化学原料碳酸二甲酯 与某物质缩合聚合,该物质属于(______)类
与某物质缩合聚合,该物质属于(______)类
A.二卤化物 B.二醇类 C.二醛类 D.二酚类
(2)硅橡胶具有无毒、无味、耐高温又耐低温,可制成耐温垫圈、密封件和人造心脏、人造血管等.它是由单体二甲基二氯硅烷(CH3)2SiCl2水解得到二甲基硅二醇,经脱水缩聚成的聚硅氧烷再经交联制成的.请用化学方程式写出上述二甲基二氯硅烷水解及线型缩聚的过程.
水解方程式为____________________________________________________
缩聚反应方程式为_______________________________________________
(3)硝酸甘油又叫三硝酸甘油酯,由1mol甘油和3mol HNO3在浓硫酸、加热条件下酯化生成,是临床上常用的抗心率失常药。该药可以丙烯为原料合成制得,其合成步骤如下:
1-丙醇![]() 丙烯
丙烯![]()
![]() 1,2,3-三氯丙烷
1,2,3-三氯丙烷![]()
![]() 三硝酸甘油酯
三硝酸甘油酯
( 提示:CH2= CHCH3 + C12 ![]() CH2= CHCH2C1+ HC1 )
CH2= CHCH2C1+ HC1 )
i:反应②的产物是_______________,反应④的产物是______________(均写结构简式)。
ii:写出③的化学方程式____________________________________
iii:如果在制取丙烯时所用的1-丙醇中混有2-丙醇,对所制丙烯的纯度有无影响? 请简要说明理由_____________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
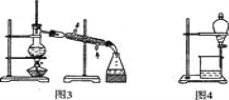
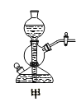
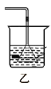
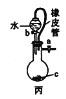
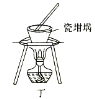
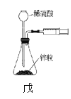
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
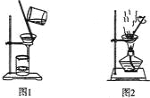
① 用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒
② 用图2所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H20晶体
③用图3所示装置从CH3OH与C4H9OH的混合物中分离出甲醇
④用图4所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯
⑤用甲装置实验室制取乙炔 ⑥乙装置下层CCl4、上层水漏斗在CCl4层,吸收HCl气体
⑦用丙装置测量气体可以减少误差 ⑧用丁装置加热融化NaOH固体
⑨用戊装置测量产生气体的体积
A. ①③⑤⑥ B. ③⑥⑦ C. ③⑥⑦⑧ D. ②④⑦⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是一种常见的过氧化物,具有强氧化性和漂白性。 通常可用作漂白剂和呼吸面具中的供氧剂。
(1)某实验小组通过下列实验探究过氧化钠与水的反应:

①用化学方程式解释使酚酞试液变红的原因___________________,依据实验现象推测红色褪去的原因是________________。
②加入MnO2的作用为_______________________。
(2)某实验小组拟验证CO2与Na2O2反应的产物,现设计以下实验装置进行实验:


①写出装置A中反应的化学方程式____________________;
②拟用装置D收集气体产物,请在方框中将装置补充完整______。
③产物检验:检验气体产物的方法:___________________;
④有同学认为该实验装置存在明显缺陷,你认为该缺陷是什么____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.碳酸的电离方程式:H2CO3 ![]() 2H+ + CO32-
2H+ + CO32-
B. 硫化钠水解: S2-+2H2O![]() H2S +2OH-
H2S +2OH-
C.往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+ S2-(aq) = Ag2S(s)
D.用醋酸除水垢: 2CH3COOH + CaCO3 = 2CH3COO- + Ca2+ + H2O + CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
Ⅰ.甲醇可以补充和部分替代石油燃料,缓解能源紧张,利用CO可以合成甲醇.
(1)已知:CO(g)+1/2O2(g)═CO2(g)ΔH1=-283.0kJ·mol-1
H2(g)+1/2O2(g)═H2O(l)ΔH2=-285.8kJ·mol-1
CH3OH(g)+3/2O2(g)═CO2(g)+2H2O(l)ΔH3=-764.6 kJ·mol-1
请写出CO与H2合成甲醇蒸汽的热化学方程式____________________
(2)一定条件下,在溶剂为VL的密闭容器中充入a molCO与2a molH2合成甲醇,平衡转化率与温度、压强的关系如图所示.

①该反应在A点的平衡常数K=_________________(用a和V表示)
②下列能说明反应达到平衡状态的是_____
A.v(CO)=v(H2) B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D. c(CO)=c(H2)
③写出能增大v(CO)又能提高CO转化率的一项措施_____________________________
Ⅱ.某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池原理:该小组设计的原理示意图如左下图,写出该电池负极的电极反应式______。
(4)电解原理:该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如图,写出开始电解时阳极的电极反应式________________。


(5)已知25℃时由Na2SO3和NaHSO3形成的混合溶液恰好呈中性,则该混合溶液中各离子浓度的大小顺序为________________________________(已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com