
【题目】I.某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_____。
(2)根据上述数据,可计算出该盐酸的浓度约为_____(保留两位有效数字)
II.亚硫酸盐是一种常见食品添加剂。为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如下:

(1)碘标准液应选用____(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行_____、洗涤、____。
(2)锥形瓶内的指示剂为_____,判断达到滴定终点的依据是________。
(3)下列操作会使测定结果偏大的有(_______)
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品w g,按乙方案测得消耗0.01000mol·L-1 I2溶液VmL,则1kg样品中含SO2的质量是____g(用含w、V的代数式表示)。
【答案】B、D、C、E、A、F 0.11mol/L 酸式 检漏(或查漏) 润洗 淀粉溶液 滴最后一滴时,溶液由无色变为浅蓝色,且半分钟内不褪色 B ![]()
【解析】
I.(1)滴定操作的步骤是选择滴定管,然后洗涤、润洗、装液、固定滴定管,然后调节液面记下读数,再取待测液于锥形瓶,然后加入指示剂进行滴定,顺序是B、D、C、E、、A、F;
(2)三次实验消耗KOH的平均体积V=![]() =22.71mL,利用c(酸)×V(酸)=c(碱)×V(碱),则该盐酸的浓度为c(HCl)=
=22.71mL,利用c(酸)×V(酸)=c(碱)×V(碱),则该盐酸的浓度为c(HCl)=![]() =0.1136mol·L-1=0.11mol·L-1;
=0.1136mol·L-1=0.11mol·L-1;
II.(1)碱式滴定管下端一段橡皮管,能与碘单质发生反应,因此碘标准液应选用酸式滴定管盛装;加注标准液之前必须对滴定管进行检漏、洗涤、润洗、装液、调液面、记录;
(2)用碘标准液滴定,指示剂为淀粉溶液,当滴入最后一滴碘标准液,溶液由无色变为浅蓝色,且半分钟内(或30s)不褪色,认为滴定到终点;
(3)利用c(待)×V(待)=c(标)×V(标)进行分析,
A、起始读数时平视,终点读数时俯视,标准液的体积减小,所测溶液的浓度偏低,故A不符合题意;
B、未用标准液润洗,造成标准液浓度偏低,消耗标准液的体积增大,即所测浓度偏大,故B符合题意;
C、步骤①中用盐酸代替硫酸,生成的SO2气体中混有少量的HCl,因SO2用碱液吸收后需要再用盐酸调节溶液至弱酸性,,因此混合溶液中含有HCl对实验结果无影响,故C不符合题意;
(4)反应③的离子方程式为SO32-+I2+H2O=SO42-+2I-+2H+,根据元素守恒以及离子方程式,因此有n(SO2)=n(SO32-)=n(I2)=V×10-3L×0.01000mol·L-1=V×10-5mol,因此1kg样品中含SO2的质量为![]() ×1000g=
×1000g=![]() g。
g。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】醋酸与醋酸钠组成的缓冲溶液对酸碱有一定的缓冲作用,缓冲能力与组分的浓度有关。室温时下列指定溶液中微粒物质的量浓度关系正确的是
A.0.1 mol·L1 CH3COOH溶液:c(CH3COOH)> c(CH3COO-) > c(H+)>c(OH-)
B.pH=8的CH3COOH和CH3COONa混合溶液:c(Na+)﹣c(CH3COO-) =9.9×10-7 mol·L-1
C.0.1 mol·L1CH3COOH溶液和0.2 mol·L-1CH3COONa溶液等体积混合:2c(Na+)= 3c(CH3COO-)+3c(CH3COOH)
D.0.2 mol·L-1CH3COOH溶液和0.1 mol·L-1NaOH溶液等体积混合:c(CH3COOH)+ 2c(H+)=c(CH3COO-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下含碳各微粒H2CO3、HCO3-和CO32-存在于CO2和NaOH溶液反应后的溶液中,它们的物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
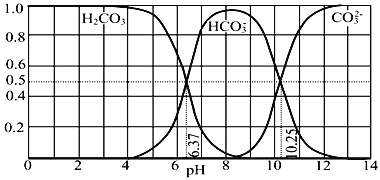
A. 为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
B. pH=10.25时,c(Na+)=c(CO32-)+c(HCO3-)
C. 根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D. 若是0.1mol NaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系: c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A. v(N2)=0.1mol·L-1·s-1 B. v(H2)=0.1mol·L-1·min-1
C. v(NH3)=0.15mol·L-1·min-1 D. v(H2)=0.3mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:

(1)①的元素符号为 _________;
(2)第3周期主族元素中,原子半径最小的是_________(用元素符号表示)。
(3)表中元素的气态氢化物中最稳定的是______________(用化学式表示)。
(4)①、②、⑦、⑧四种元素的最高价氧化物的水化物中酸性最强的是______(用化学式表示)。
(5)①和⑧形成化合物的电子式为_________________
(6)④和⑥两种元素的最高价氧化物的水化物在水溶液中反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜[CuaClb(OH)c·xH2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如下图所示。步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。

下列有关说法正确的是
A. a、b、c 之间的关系式为:a=b+c
B. 图中M、N分别为Fe2+、Fe3+
C. 步骤1充分反应后,加入少量CuO是为了除去Fe3+
D. 若制备1 mol的CuCl2,理论上消耗11.2 LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。液体A和气体B的组合不可能是( )

A. 氢氧化钠溶液、一氧化氮
B. 水、氨气
C. 氢氧化钠溶液、二氧化碳
D. 水、二氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度和压强相同时,在体积相同的两个密闭容器甲和乙,甲中充满O2气体,乙中充满O2和O3的混合气体,下列说法正确的是
A. 两容器中气体的质量相等 B. 两容器中气体的分子数目相等
C. 两容器中气体的氧原子数目相等 D. 两容器中气体的密度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com