
下列溶液中,Cl﹣的物质的量浓度与50mL 1mol/L AlCl3溶液中Cl﹣物质的量浓度相等是()
A. 100mL 1mol/LNaCl溶液 B. 150mL 3mol/LKCl溶液
C. 75mL 1mol/LMgCl2溶液 D. 25mL 2mol/LAlCl3溶液
考点: 物质的量浓度.
专题: 物质的量浓度和溶解度专题.
分析: 电解质溶液中离子浓度=电解质浓度×化学式中相应离子数目,与溶液体积无关,50mL 1mol/L的AlCl3溶液中Cl﹣的物质的量浓度为3mol/L,结合选项计算判断.
解答: 解:50mL 1mol/L的AlCl3溶液中Cl﹣的物质的量浓度为1mol/L×3=3mol/L,
A.100mL 1mol/L的NaCl溶液中Cl﹣的物质的量浓度为1mol/L×1=1mol/L,故A不符合;
B.150mL 3mol/L的KCl溶液中Cl﹣的物质的量浓度为3mol/L×1=3mol/L,故B符合;
C.75mL 1mol/L的MgCl2溶液中Cl﹣的物质的量浓度为1mol/L×2=2mol/L,故C不符合,
D.25mL 2mol/L的AlCl3溶液中Cl﹣的物质的量浓度为2mol/L×3=6mol/L,故D不符合;
故选B.
点评: 本题考查物质的量浓度有关计算,比较基础,注意根据化学式理解电解质浓度与离子浓度关系,有利于基础知识的巩固.


科目:高中化学 来源: 题型:
某溶液的溶质可能由下列离子组成:Cl﹣、SO42﹣、CO32﹣、H+、Ba2+、Na+,某同学进行了如下实验:
(1)向溶液中加入过量的BaCl2溶液,有白色沉淀产生,过滤;
(2)向(1)中滤液里加入AgNO3溶液,有白色沉淀产生;
(3)将足量稀盐酸加入(1)的沉淀中,沉淀部分消失,有气体产生.
依据以上实验回答下列问题;
(1)原溶液中一定含有 ;
(2)一定没有 ;
(3)可能含有 ;如果要确定原溶液中是否存在该离子,应选用试剂是 ;
A.稀HNO3 B.Ba(NO3)2 C.AgNO3 D.Na2CO3
(4)写出(3)中沉淀消失的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素X的气态氢化物在高温下分解为固态的X单质和H2,分解反应前后气体的质量之比是17:1.下列有关叙述中错误的是()
A. X的阴离子的电子排布式是1s22s22p63s23p6
B. X的最高价氧化物对应的水化物的酸性比砷酸强
C. X的最高价氧化物中,X的质量分数为50%
D. X的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
A. 检验Cl﹣离子的试剂是硝酸银溶液和稀硝酸
B. 检验SO42﹣离子的试剂一般用氯化钡溶液和稀盐酸
C. 检验CO32﹣离子的试剂用盐酸和澄清石灰水
D. 在某溶液中加入BaCl2溶液产生白色沉淀,证明溶液中有SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式中,正确的是()
A. Na2SO4=2Na++SO4﹣2 B. Ba(OH)2=Ba2++OH2﹣
C. Ca(NO3)2=Ca2++2(NO3)2﹣ D. Al2(SO4)3=2Al3++3SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是()
A. 常温常压下,11.2L氧气所含的原子数为NA
B. 在常温常压下,22g二氧化碳中含有的原子数为1.5 NA
C. 在标准状况下,5.6L四氯化碳含有的分子数为0.25NA
D. 在非标准状况下,22.4LO2含有的分子数一定不是NA
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需用400mL 1.0mol/L的NaOH溶液,若用NaOH固体来配制.可供选择的仪器有100mL、250mL、500mL和1000mL四种不同规格的容量瓶,烧杯,托盘天平,药匙,100mL的量筒.还缺少的必要仪器是 ,需称取NaOH固体的质量是20g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子中,能在强酸性溶液中大量共存的是( )
A. Na+、K+、SO42﹣、OH﹣ B. Na+、K+、Cl﹣、HCO3﹣
C. Na+、Cu2+、CO32﹣、Br﹣ D. Na+、Mg2+、NO3﹣、Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生用0.2000mol•L﹣1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
①用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④移取20.00mL待测液注入洁净的还存有少量蒸馏水的锥形瓶中,并加入3滴酚酞试液;
⑤用标准液滴定至终点,记下滴定管液面读数.
请回答:
(1)以上步骤有错误的是(填编号) ,若测定结果偏高,其原因可能是 .
A.配制标准溶液的固体NaOH中混有KOH杂质
B.滴定终点读数时,仰视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
(2)判断滴定终点的现象是: .
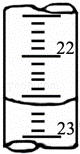
(3)如图是某次滴定时的滴定管中的液面,其读数为 .
(4)根据下列数据:请计算待测盐酸溶液的浓度: mol/L.
滴定次数 待测体积(mL) 标准烧碱体积(mL)
滴定前读数 滴定后读数
第一次 20.00 0.40 20.40
第二次 20.00 2.00 24.10
第三次 20.00 4.00 24.00
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com