
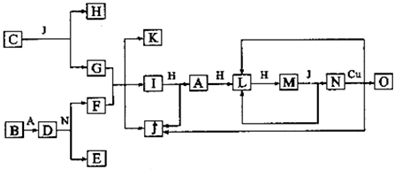
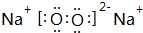
 ,
, ;
;
| ||
| ||


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、③⑤⑦① | B、②③⑦① |
| C、②⑤⑦① | D、④②⑥① |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:
利用太阳能分解水产生H2,在催化剂作用下H2与CO2反应合成CH3OH,并开发出直接以甲醇为燃料的燃料电池.已知:| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| nB |
| tB |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
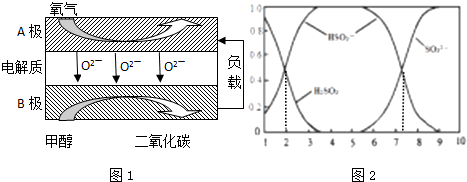
查看答案和解析>>
科目:高中化学 来源: 题型:
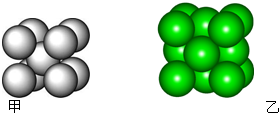 某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.
某金属晶体M有两种堆积形式,如图甲和乙,在T℃以上时甲可以转变为乙,这两种结构中最邻近的原子间距离相同.| 金属 | 相对原子质量 | 密度/g?cm-3 | 原子化热/kJ?mol-1 |
| Na | 22.99 | 0.960 | 108.4 |
| M | 60.20 | 7.407 | 7735 |
| 3 |
| 200 |
| 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在化学反应中,断开反应物中的化学键要吸收能量 |
| B、共价化合物一定含共价键,可能含离子键 |
| C、离子化合物中只含离子键,不含共价键 |
| D、化学反应中的能量变化都表现为热量变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com