
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| N(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)根据元素周期表的结构以及元素在表中的位置来回答;
(2)根据溶液中电荷守恒C(K+)+C(NH4+)+c(Na+)+C(H+)=2C(SO42-)+C(NO3-)+C(Cl-)+c(OH-)计算;
(3)根据溶液中HSO3-浓度和SO32-浓度的相对大小确定溶液的酸碱性;
(4)利用盖斯定律计算反应热,得到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变.
解答 解:(1)As是第ⅤA的元素,在周期表中的第四周期,和N元素是同一主族,故答案为:As;四;ⅤA;
(2)溶液中遵循电荷守恒:c(K+)+c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(NO3-)+c(Cl-)+c(OH-),铵根离子水解,溶液显示酸性,氢氧根离子浓度可以忽略不计,即:3×10-6+7×10-6+3×10-5+c(H+)=2×3×10-5+5×10-5+2×10-5,解c(H+)=10-4mol•L-1,pH值为4,故答案为:4;
(3)在溶液中主要以HSO3-存在,HSO3-的电离很微弱,所以n(SO32-):n(HSO3-)<1:1,根据表格知,当亚硫酸氢根离子的物质的量大于亚硫酸根离子的物质的量时,亚硫酸氢钠溶液呈酸性;亚硫酸氢钠溶液中存在HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度,所以亚硫酸根离子的物质的量大于亚硫酸氢根;
故答案为:酸;HSO3-存在:HSO3-?SO32-+H+和HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于水解程度;
(4)已知:①2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1,利用盖斯定律将①×$\frac{1}{2}$-②×$\frac{1}{2}$得NO2(g)+SO2(g)?SO3(g)+NO(g)
△H=$\frac{1}{2}$×(-196.6kJ•mol-1)-$\frac{1}{2}$×(-113.0kJ•mol-1)=-41.8kJ•mol-1,
a.无论是否达到平衡,体系压强都保持不变,不能用于判断是否达到平衡状态,故a错误;
b.混合气体颜色保持不变,说明浓度不变,达到平衡状态,故b正确;
c.SO3和NO的计量数之比为1:1,无论是否达到平衡,二者的体积比保持不变,不能判断是否达到平衡状态,故c错误;
d.物质的量之比等于化学计量数之比,则每消耗1mol SO3的同时生成1molNO2,不能判断是否达到平衡状态,故d错误.
故答案为:-41.8;b.
点评 本题综合考查化学平衡移动、盖斯定律以及弱电解质的电离和盐的水解等问题,侧重于学生综合运用化学知识的能力的考查,题目难度中等.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
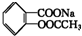 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量NaOH溶液共热后,再加盐酸 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,B中具有的官能团的名称酯基、溴原子.
,B中具有的官能团的名称酯基、溴原子.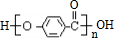 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com