
下列实验操作中,错误的是( )
A.配制5%食盐溶液时,将称量的食盐放入烧杯中加适量的水搅拌溶解
B.硫酸铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C.测定未知NaOH溶液浓度时,酸式滴定管需用标准酸 液润洗2~3次
液润洗2~3次
D.配制0.1 mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量 瓶中加水稀释
瓶中加水稀释
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A.吸热反应不加热就不会发生;
B.需要加热才能发生的反应一定是吸热反应;
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小;
D.放热的反应在常温下一定很容易发生。
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度
为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K ,每次实
,每次实
验HNO3的用量为25.0 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol·L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3的浓度对该反应速率的影响; (Ⅱ)实验①和________探究温度对该反应速率的影响; (Ⅲ)实验①和________探究大理石规格 (粗、细)对该反应速率的影响。 |
| ② | ||||
| ③ | ||||
| ④ |
(2)实验①中CO2质量随时间变化的关系见下图:
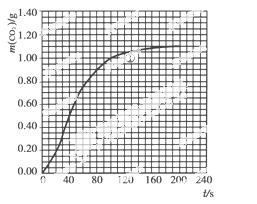
依据反应方程式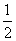 CaCO3+HNO3===
CaCO3+HNO3===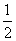 Ca(NO3)2+
Ca(NO3)2+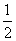 CO2↑+
CO2↑+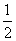 H2O,计算实验①在70~90 s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70~90 s范围内HNO3的反应速率(忽略溶液体积变化,写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙两物质的溶解度曲线如图所示.下列叙述中,正确的是  ( )
( )
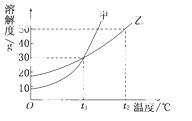 A.t1℃时
A.t1℃时 ,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
,在100 g水中放入60 g甲,其溶质的质量分数为37.5%
B.t1℃时,甲和乙的饱和溶液的物质的量浓度一定相等
C.t2℃时,甲和乙的饱和溶液中溶质的质量分数一定相等
D.t2℃时,分别在100 g水中各溶解20 g甲、乙,同时降低温度,
甲先达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
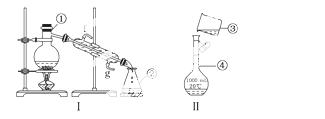
(1)写出下列仪器的名称:
① ,② ,④ 。
(2)仪器①~④中,使用时必须检查是否漏水的有 (填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;冷凝管的进水口是 (填“f”或“g”);现需配制250 mL 0.2 mol/L NaCl溶液,装置Ⅱ是某同学转移溶液的示意图,图中的错误是:  。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
v L Fe2(SO4)3溶液中含有a g SO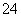 ,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
,取此溶液0.5v L,用水稀释至2v L,则稀释后溶液中Fe3+的物质的量浓度为
A.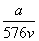 mol·L-1 B.
mol·L-1 B.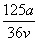 mol·L-1
mol·L-1
C.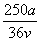 mol·L-1 D.
mol·L-1 D.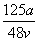 mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是
A. 浓硝酸保存在玻璃塞的棕色试剂瓶中
B. 已经完成定容的500 mL 1.0 mol·L-1 的NaOH溶液,某同学不慎将容量瓶中溶液洒出,只能重新配制
C. 导管口点燃CO时需要验纯,H2加热还原CuO时也需要验纯
D. 物质溶于水的过程中,一般有放热或吸热现象,因此溶解的操作不能在量筒中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关“规定”正确的是
A.PH小于7的雨水称为酸雨
B.空气中直径大于2.5μm的颗粒物称为PM2.5
C.分散质粒子直径介于1nm~100nm之间的分散系称为胶体
D.标况下的气体摩尔体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,将3molA和1molB两种气体混合
于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(s)。2min末该反应达到平衡,
xC(g)+2D(s)。2min末该反应达到平衡,
生成0.8molD,并测得C的浓度为0.2mol/L。下列判断正确的是
A.该条件下此反应的化学平衡常数约为0.91
B.A的平均反应速率为0.3mol/(L·s)
C.B的转化率为60%
D.若混合气体的密度不再改变时,该反应不一定达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com