


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 2 | Li | Be | B | C | N | O | F |
| 3 | Na | Mg | Al | Si | P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
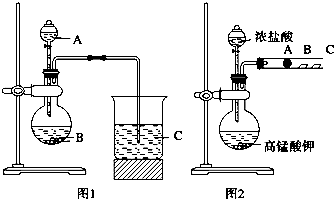
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸性:HClO4>H3PO4>H2SO4 |
| B、碱性:KOH>NaOH>Mg(OH)2 |
| C、离子半径:O2->F->Cl->Na+ |
| D、氢化物稳定性:H2S>HF>H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热至50℃,溶液的Ca2+的浓度增大 | ||
B、该温度下Ca(OH)2的溶解度为
| ||
| C、该饱和石灰水中,水电离出的OH-的浓度为10-12mol/L | ||
D、加入生石灰并恢复至常温后,
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com