
| A. | Z元素的含氧酸是最强酸 | B. | 原子半径:X>Z | ||
| C. | 气态氢化物热稳定性:W>X | D. | W与Y可以存在于同一离子化合物中 |
分析 W、X、Y、Z均为的短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,则X为O元素,Y为S元素,O、S元素核电荷数之和与W、Z的原子序数之和相等,则W、Z的原子序数之和24,而且W的原子序数小于O,Z的原子序数大于S,则Z为Cl元素,所以W的原子序数为24-17=7,即W为N元素;结合元素化合物性质判断和元素周期律分析解答.
解答 解:W、X、Y、Z均为的短周期主族元素,原子序数依次增加,X与Y形成的化合物能与水反应生成酸且X、Y同主族,则X为O元素,Y为S元素,O、S元素核电荷数之和与W、Z的原子序数之和相等,则W、Z的原子序数之和24,而且W的原子序数小于O,Z的原子序数大于S,则Z为Cl元素,所以W的原子序数为24-17=7,即W为N元素;
A、Z为Cl元素,Cl元素的最高价含氧酸是最强酸,其它价态的含氧酸的酸性不一定强,如HClO是弱酸,故A错误;
B、电子层越多,原子半径越大,所以O<Cl,即原子半径:X<Z,故B错误;
C、元素的非金属性越强,其氢化物越稳定,非金属性O>N,所以气态氢化物热稳定性:W<X,故C错误;
D、N与S可以存在于同一离子化合物中,如硫酸铵中含有N、S,故D正确.
故选:D.
点评 本题以元素推断为载体,考查原子结构位置与性质关系、元素化合物知识,题目难度不大,推断元素是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 950mL、20.14g | B. | 950mL、10.07g | C. | 1000mL、21.20g | D. | 1000mL、10.60g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热△H=-241.8KJ/mol | |
| B. | 相同条件下,充分燃烧1molH2(g)与1molS(g)的混合物比充分燃烧1mol H2S(g)放热多20.1kJ | |
| C. | 由①②知,水的热稳定性小于硫化氢 | |
| D. | ②中生成固态硫,△H将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用化学工艺调整织物孔隙直径,可以制作出防水透气面料 | |
| B. | 食品包装内常放置具有吸水性的化学药品以保持干燥,如生石灰和硅胶 | |
| C. | 合金广泛应用于现代建筑业,与金属晶体的韧性、可塑性有关 | |
| D. | 使用无铅汽油的汽车尾气不会污染空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
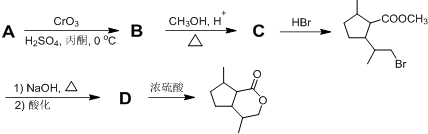
 ,B含有的官能团的名称是羧基、碳碳双键.
,B含有的官能团的名称是羧基、碳碳双键.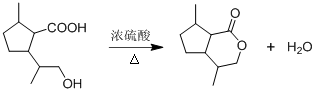 .
. ,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号).
,若该高聚物平均相对分子质量约为20000,则其平均聚合度约为c(填标号). ,其分子中最多有8个碳原子在同一平面上.
,其分子中最多有8个碳原子在同一平面上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | S=O(SO2) | O=O(O2) | S=O(SO3) |
| 能量/KJ | 535 | 496 | 472 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 与乙醇发生酯化反应生成产物的分子式为C8H18O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物可以发生银镜反应 | |
| D. | 标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com