
| A. | ②③⑤ | B. | ③④⑤ | C. | ②④ | D. | ①②③ |
分析 酸性溶液中,氧化性HNO3>Fe3+,硫化氢不足,硝酸根离子氧化硫化氢;硫化氢足量,则Fe(NO3)3完全反应,以此来解答.
解答 解:酸性溶液中,氧化性HNO3>Fe3+,硫化氢不足,硝酸根离子氧化硫化氢,由电子、电荷守恒可知,离子反应为3H2S+2NO3-+2H+=2NO↑+3S↓+4H2O,故①错误,
硫化氢足量,则Fe(NO3)3完全反应,由电子、电荷守恒可知,离子反应为Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O,故③正确,
当硫化氢将硝酸根全部还原后,再通入硫化氢发生离子反应为2Fe3++H2S═2Fe2++S+2H+,故②正确;
当硝酸根离子全部反应,而铁离子部分反应,如铁离子与硝酸根离子的物质的量之比为:1:5时,离子方程式为:Fe3++5NO3-+8H2S+4H+═5NO+8S+Fe2++10H2O,故⑤正确;
而Fe3++7NO3-+10H2S+8H+═7NO+10S+Fe2++14H2O中也是亚铁离子部分反应,但得失电子不守恒,故④错误;
综上所述②③⑤正确,
故选A.
点评 本题考查氧化还原反应及离子反应的书写,为高频考点,把握发生的化学反应及电子守恒为解答的关键,侧重氧化还原反应的离子反应考查,注意氧化性的强弱及反应的先后顺序,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol ${\;}_{92}^{235}$U核素含有中子数为235NA | |
| B. | 1 L 0.l mol•L-1的醋酸溶液中含有H+数目为0.1NA | |
| C. | 标准状况下,22.4L乙烯和丙烯的混合气体中含有的碳原子数目为2.5NA | |
| D. | 常温常压下,l.6gCH4中含有共价键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
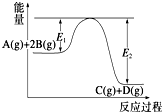
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 升高温度,平衡常数K减小;压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时SO2的消耗速率必定等于SO3的生成速率相等 | |
| B. | 平衡时SO2、O2、SO3的分子数之比为2:1:2 | |
| C. | 平衡时SO2的消耗速率必定等于O2的生成速率的2倍 | |
| D. | 若反应在恒容容器中进行,气体密度保持不变,可以判定反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
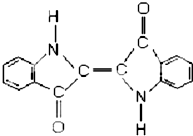
| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是 C16H10N2O2 | ||
| C. | 该物质是苯的同系物 | D. | 它含有碳碳双键、羰基等官能团 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com