
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
分析 X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,则X可能为H、Li、Na等元素,Y可能为O、S等元素,以此进行解答.
解答 解:X、Y为短周期元素,X位于IA族,X与Y可形成化合物X2Y,则Y为第ⅥA族元素,则X可能为H、Li、Na等元素,Y可能为O、S等元素.
A.当X为H元素,Y为O、S元素时,X的原子半径小于Y的原子半径,故A错误;
B.X为Na时,其对应离子为Na+,离子有10个电子,Y为O元素时,其对应的离子为O2-,离子有10个电子,二者具有相同的电子层结构,故B正确;
C.两元素形成的化合物中,原子个数为1:1的有H2O2或Na2O2,故C正确;
D.当X为Li、Y为O或X为Na、Y为S时,二者处于同一周期,故D错误,
故选BC.
点评 本题考查位置结构性质关系及应用,题目难度不大,注意元素周期表中各主族元素的主要性质的相似性和递变性的应用.


科目:高中化学 来源: 题型:选择题
| A. | Na2O2的电子式为 | |
| B. | 16g甲烷完全燃烧生成的CO2为11.2L(标准状况) | |
| C. | 在氮原子中,质子数为7而中子数不一定为7 | |
| D. | Cl-的结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②⑥ | B. | 只有①⑥ | C. | 只有⑥ | D. | 只有①④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

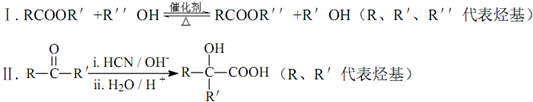
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物对应水化物的酸性:H2SiO3>H3PO4>H2SO4 | |
| B. | 与冷水的反应速率:K>Na>Mg | |
| C. | 热稳定性:HF>HCl>H2S | |
| D. | 离子半径:Cl->F->Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯中碳碳双键的个数为3 NA | |
| B. | 含0.2molH2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA | |
| C. | 0.1mol/L的FeCl3溶液中含有0.1NA个Fe3+ | |
| D. | 在标准状况下,2.24 L NO和1.12 L O2混合后的原子总数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:F>Cl,则熔点NaF>NaCl | |
| B. | 钠单质与水反应剧烈,锂单质与水反应也十分剧烈 | |
| C. | 干冰(CO2)是分子晶体,则SiO2也是分子晶体 | |
| D. | ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S、H2O、HF的稳定性依次增强 | |
| B. | RbOH、KOH、Ca(OH)2的碱性依次减弱 | |
| C. | Na+、Mg2+、Al3+的半径依次增大 | |
| D. | H3SiO3、H2CO3、H2SO4的酸性依次增强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com