
| A. | 溴乙烷 | B. | 二溴乙烷 | C. | 甲基己烯 | D. | 二甲苯 |
分析 纯净物是由一种物质组成的,混合物是由两种或两种以上物质组成的,若选项中有机物不存在同分异构体,则该有机物为纯净物,否则为混合物,据此进行判断.
解答 解:A.乙烷分子中所有氢原子都等效,则溴乙烷不存在同分异构体,所以溴乙烷为纯净物,故A正确;
B.二溴乙烷中存在两种同分异构体,所以二溴乙烷为混合物,故B错误;
C.己烯存在多种同分异构体,如1-己烯、2-己烯等,甲基己烯未指明甲基的位置,故不一定为纯净物,故C错误;
D.二甲苯存在邻、间、对三种同分异构体,所以二甲苯不一定为纯净物,故D错误;
故选A.
点评 本题考查了同分异构体、纯净物与混合物的判断,题目难度不大,注意掌握纯净物与混合物的区别,明确含有同分异构体的有机物为混合物,不存在同分异构体的有机物为纯净物.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | c(X2)=0.15 mol•L-1 | B. | c(Y2)=0.7 mol•L-1 | ||
| C. | c(Y2)=0.3 mol•L-1 | D. | c(Q2)=0.6 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.08mol/L | B. | 0.0018mol/L | C. | 0.075mol/L | D. | 0.0075mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有Cl- | B. | 一定有SO42- | C. | 一定没有Al3+ | D. | 一定没有SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;HCl.
;HCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
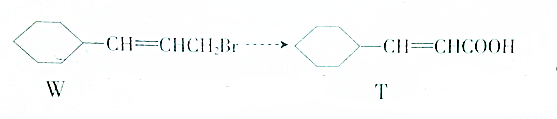
| A. | ①③②④ | B. | ③①④② | C. | ②①③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硼的原子半径大于铍的原子半径 | |
| B. | 氯化铍分子中铍原子的最外层电子数是8 | |
| C. | 氢氧化铍的碱性比氢氧化钙弱 | |
| D. | 单质铍跟冷水反应产生氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com