
【题目】铝生产加工过程中产生大量的铝灰,直接掩埋造成铝资源浪费,还会带来严重的污染。某铝厂的铝灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,其他杂质均不溶于稀硫酸。如图是酸浸法用该铝灰生产高纯氧化铝的生产流程:
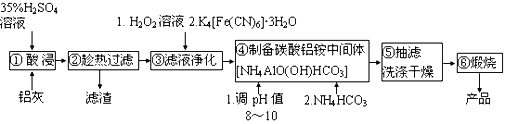
已知:i.Fe3+ +K++ [Fe(CN)6]4-=K[Fe(CN)6Fe]↓
ii.AlN常温下与水缓慢反应,酸性或碱性条件下反应较快
iii.NH4AlO(OH)HCO3难溶于碱性溶液和乙醇
请回答:
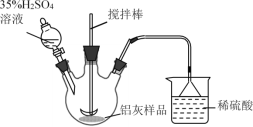
(1)实验室模拟工业生产①酸浸步骤的装置如图,该装置的不合理之处为____。
(2)步骤③加入H2O2溶液的目的是________________。
(3)步骤④调节pH最合适的试剂是________________。
A.NaOH B.H2SO4 C.NH3·H2O D.Ca(OH)2
(4)步骤⑤吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,_______,洗涤沉淀操作为_______________。
(5)写出煅烧碳酸铝铵中间体得到高纯氧化铝的化学方程式______________。
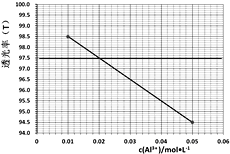
(6)已知Al3+对光的吸收与其浓度成线性关系,色度计传感器可以测量某种波长的光穿过溶液的透射率确定溶液浓度。如图是红色光照下透光率(T)对应c(Al3+)的标准曲线。为测定铝灰中铝元素的回收率,准确称取0.5000g铝灰(折合铝元素含量60.00%)进行制备高纯氧化铝的实验,将所制得的粉末与固体NaOH反应后加水溶解、过滤,滤液定容到250mL容量瓶中。用移液管移取25.00mL到锥形瓶中,加2滴指示剂,滴加稀盐酸至溶液体积变为50.00mL,NaAlO2恰好反应生成AlCl3。取该溶液于比色皿中进行色度检测,测得溶液透光率为97.5,则铝元素的回收率=_________。
【答案】尾气无法用稀硫酸完全吸收或可燃性气体未处理 将Fe2+氧化为Fe3+,便于形成沉淀除去 C 从吸滤瓶上口倒出滤液 往过滤器中加水至没过沉淀,待水滤出后,重复操作2~3次,直至滤液检验不出SO42-,再用少量乙醇淋洗 2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑ 90.0%
Al2O3+2NH3↑+3H2O+2CO2↑ 90.0%
【解析】
(1)根据反应原理,观察反应装置和尾气处理装置,找出不合理之处;
(2)流程中步骤③是为了把铁离子转变为沉淀除去,那么加入H2O2溶液的目的也是与之关联的,分析铁元素的存在形态就可确定双氧水的作用;
(3)步骤④调节pH最合适的试剂是谁?从反应的角度、不引入杂质离子的角度分析选择;
(4)步骤⑤的操作要抓住其要点简答;
(5)煅烧碳酸铝铵中间体得到的产物,除了高纯氧化铝外,其余产物可以结合酸式碳酸盐分解规律、不溶性碱分解规律、铵盐非氧化还原分解规律获得并据此写化学方程式;
(6)获得相关数据及题目提供的信息,可计算铝元素的回收率;
(1) 铝灰经分析所含主要物质如下:Al、Al2O3、AlN、SiO2、Fe2O3,在搅拌下,铝灰和从分液漏斗加入的硫酸反应,产生的气体有氨气、氢气等,可见装置中尾气无法用稀硫酸完全吸收或可燃性气体氢气未处理;
答案为:尾气无法用稀硫酸完全吸收或可燃性气体未处理;
(2)流程中步骤③是为了把杂质中铁元素转变为沉淀除去,有大量铝情况下,溶液中有铁离子存在、也有亚铁离子,则加入绿色氧化剂H2O2溶液的目的是将Fe2+氧化为Fe3+,便于形成沉淀除去;
答案为:将Fe2+氧化为Fe3+,便于形成沉淀除去;
(3)步骤④要制备NH4AlO(OH)HCO3,信息iii显示——NH4AlO(OH)HCO3难溶于碱性溶液,故要把酸性溶液调节成弱碱性,则可用碱性物质调节pH,为了避免引入新杂质最合适的试剂是氨水,则选C;
答案为:C;
(4)步骤⑤是用抽滤法分离出碳酸铝铵中间体,吸滤瓶内液体高度快达到支管口位置时应拔掉瓶上橡皮管,从吸滤瓶上口倒出滤液;而洗涤沉淀的操作则为:往过滤器中加水至没过沉淀,待水滤出后,重复操作2~3次,直至滤液检验不出SO42-,再用少量乙醇淋洗,便于快速得到纯净干燥的固体(因为信息iii,NH4AlO(OH)HCO3难溶于碱性溶液和乙醇);
答案为:从吸滤瓶上口倒出滤液;往过滤器中加水至没过沉淀,待水滤出后,重复操作2~3次,直至滤液检验不出SO42-,再用少量乙醇淋洗;
(5)煅烧碳酸铝铵中间体得到的产物,除了高纯氧化铝外,其余产物分别为氨气、二氧化碳和水,则化学方程式为2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑;
Al2O3+2NH3↑+3H2O+2CO2↑;
答案为:2NH4AlO(OH)HCO3![]() Al2O3+2NH3↑+3H2O+2CO2↑;
Al2O3+2NH3↑+3H2O+2CO2↑;
(6)由图知,透光率为97.5时,溶液中铝离子的浓度为0.02mol/L,则结合其它相关数据,铝元素的回收率= ;
;
答案为:90.0%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。下列说法正确的是

A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高价氧化物对应水化物的酸性:Z<Y
C. X元素与Y、Z、M三种元素只能各形成一种共价化合物
D. Y、R的单质分别都能与其他物质反应置换出X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复旦大学教授吴宇平研制的水溶液锂电池体系,最终能实现电动汽车充电10秒即可行驶400公里的目标,其结构如图所示,则下列说法不正确的是

A.b电极采用多孔电极的目的是易于吸附气体
B.a电极为电池的正极,金属锂发生氧化反应
C.b电极的电极反应为O2+2H2O+4e-=4OH-
D.装置中用导电隔离层将电极锂与水溶液隔开的目的是防止金属锂与水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢溴酸在医药和石化工业上有广泛用途。如图是模拟工业制备氢溴酸粗品并精制流程:
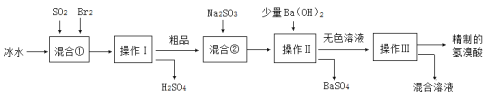
下列说法不正确的是
A.冰水的目的是降低反应温度,防止溴挥发,使反应更充分
B.混合①发生的反应为:SO2 +2H2O + Br2=H2SO4 + 2HBr
C.操作Ⅱ和操作Ⅲ的名称分别为过滤和蒸馏
D.Na2SO3的作用是调节溶液的pH也可以用Na2CO3替代
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石中铁元素以氧化物FemOn形式存在,现进行如下实验:称取25.0 g样品溶于稀硫酸中,加热搅拌,滤去不溶物。向滤液中加入10.0 g铜粉充分反应后过滤、洗涤、干燥得固体3.6 g。剩下滤液用2 mol·L-1的酸性KMnO4滴定,消耗KMnO4溶液25.00 mL。
(1)该铁矿石中铁元素的质量分数为________(保留三位有效数字);
(2)氧化物FemOn的化学式中m=____,n=____(m、n为正整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①C(s、金刚石) + O2(g)=CO2(g) ΔH1=-395.4 kJmol-1,② C(s、石墨) + O2(g)=CO2(g) ΔH2=-393.5 kJmol-1 上述反应中的能量变化如图所示,下列说法正确的是

A.石墨和金刚石之间的转化是物理变化
B.图中 b 代表反应①的能量变化
C.C(s、金刚石) =C(s、石墨) ΔH= +1.9 kJmol-1
D.金刚石比石墨的热稳定性好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锌碘液流电池具有能量密度高、循环寿命长等优势,其工作原理如图所示。下列说法错误的是

A. 放电时电流从石墨电极流向锌电极
B. 充电时阳极反应式为:3I--2e-=I3-
C. 若将阳离子交换膜换成阴离子交换膜,放电时正负极也随之改变
D. 放电时左侧电解质储罐中的离子总浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
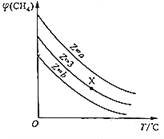
A. 该反应的焓变△H<0
B. 图中Z的大小为b<3<a
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)增大
(CH4)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
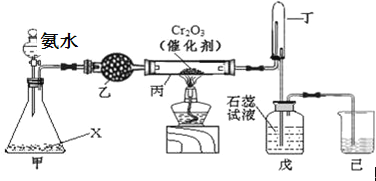
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com