
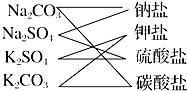
 如图所示是对Na2CO3、Na2SO4、K2CO3、K2SO4四种物质进行的分类,这种分类方法的名称是( )
如图所示是对Na2CO3、Na2SO4、K2CO3、K2SO4四种物质进行的分类,这种分类方法的名称是( )| A、交叉分类法 | B、树状分类法 |
| C、圈图法 | D、链状箭头法 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是七个基本物理量之一 |
| B、阿伏加德罗常数是没有单位的 |
| C、氮气的摩尔质量是28 g |
| D、1 mol H2O约含有6.02×1023个水分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将10g氢氧化铁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化铁溶液,c(OH-)=3×10-10mol/L |
| B、将10g氢氧化镁粉末加入100mL水中,充分搅拌后仍有固体剩余,静置后上层清液为饱和氢氧化镁溶液,加入酚酞试液后不能变红 |
| C、若1mol/L氯化镁溶液中混有氯化铁,调节pH=9,可以保证镁离子不沉淀而铁离子沉淀完全 |
| D、根据溶度积数据,可以计算出氢氧化铁固体与盐酸反应:Fe(OH)3+3H+?Fe3++3H2O的平衡常数为2.7×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、24 | B、32 | C、40 | D、48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向水中加入氢氧化钠,平衡逆向移动,c(H+)降低,c(OH-)增大 |
| B、向水中加入少量固体硫酸氢钠,c(H+)增大,Kw变大 |
| C、向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低 |
| D、将水加热,Kw增大,c(H+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com