
【题目】40℃,向体积为VL的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是

A.X是N2O
B.1 min~3 min时,v(NO2)=1/6Vmol·(L·min)-1
C.40℃时该反应的平衡常数为1
D.NO2和X的浓度相等可以作为判断反应到达平衡的标志
【答案】AB
【解析】
根据图像变化,3分钟时反应达到平衡,一氧化氮在减少,二氧化氮和X在增加,则一氧化氮为反应物,二氧化氮与X为生成物,一氧化氮的变化量为3mol,二氧化氮与X为生成物变化量分别为1mol,化学计量系数之比等于参与反应各组分的物质的量的变化量之比,则反应方程式为3NO= NO2+X,根据原子守恒,则X的化学式为N2O。平衡时,NO剩余1mol ,NO2和N2O分别为1mol。
A. 根据上述分析,X是N2O,故A正确;
B. 根据图像分析,1 min~3 min时,二氧化氮物质的量的变化量分别为![]() mol ,v(NO2)=
mol ,v(NO2)=![]() =1/6Vmol·(L·min)-1,故B正确;
=1/6Vmol·(L·min)-1,故B正确;
C. 40℃时该反应的平衡常数为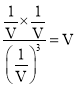 ,故C错误;
,故C错误;
D. 反应进行到任意时刻,NO2和X的浓度都相等,不代表NO2和X的浓度保持不变,不能作为判断反应到达平衡的标志,故D错误;
答案选AB。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
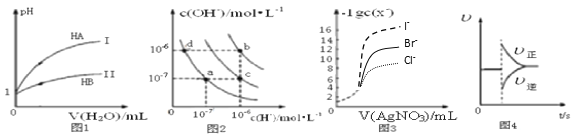
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,0.3molX(g)与Y(g)在容积固定的密闭容器中发生反应:X(g)+3Y(g) ![]() 2Z(g), ΔH=-aKJ/mol,下列说法正确的是
2Z(g), ΔH=-aKJ/mol,下列说法正确的是
A. 反应一段时间后,X与Y的物质的量之比仍为1:1
B. 达到平衡时,且反应放出0.1aKJ的热量
C. 达到平衡后,若向平衡体系中充入西游气体,Z的正反应速率将不发生变化
D. X的体积分数保持不变,说明反应已达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )
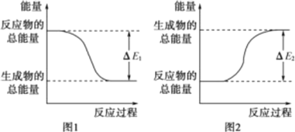
A.铵盐和碱混合即可反应,其能量变化符合图 1
B.0.1mol H2SO4 溶液和 0.1mol Ba(OH)2 溶液的反应符合图 2,且吸收热量为ΔE2
C.0.1mol HCl 溶液和 0.1mol NaOH 溶液的反应符合图 1,且放出热量为ΔE1
D.发生图 1 能量变化的任何反应,一定不需要加热即可发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是几种烷烃的球棍模型,试回答下列问题:

(1) A、B、C 三者的关系是_______________
(2) A 的分子式为_______________,C 的名称为______________
(3)写出C 的同分异构体的结构简式______________
(4) B 是 2008 年北京奥运会火炬燃料的主要成分,若 22g B 气体完全燃烧,生成 CO2 气体和液态水,放出 1108 kJ 热量,则其燃烧的热化学方程式为_____________________________________________________________________________________.
(5)D 为六个碳的烷烃,且其一氯代物只有两种,写出 D 的结构简式_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
H2O(g)=H2O(l) ΔH=c kJ·mol1
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =______kJ·mol1
(2)H2(g)+1/2O2(g)=1/2H2O(l)的过程如下图所示,H-O键的键能是______kJ·mol1。

(3)某化学兴趣小组用甲醇燃料电池来模拟铝制品表面“钝化”处理过程(装置如图甲所示)。a电极发生的电极反应方程式为______。实验结束后若硫酸溶液质量减少1.08 g,则石墨电极处生成的气体在标准状况下的体积为______L。

(4)一种Na-CO2二次电池装置如图乙所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。充电时的阳极反应式为______。
2Na2CO3+C。充电时的阳极反应式为______。
(5)海水中含有大量的HCO3-,一种利用海水提取CO2的装置如图丙所示。结合方程式简述提取CO2的原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为前四周期元素,且原子序数依次增大。A是元素周期表中半径最小的元素,B的基态原子2p轨道上未成对电子数是C的3倍;D的基态原子含13种运动状态不同的电子;E与A位于同一主族;F2+的3d轨道中有9个电子。(答题时用字母对应的元素符号表示)
⑴元素A、B、C的电负性由大到小的顺序为______。
⑵F的基态原子价层电子排布式为______。
⑶BC3的空间构型为______,与BC3互为等电子体的一种阴离子的化学式为______。
⑷一种化合物X的晶体结构如图,X的化学式为______。 (图中○:E+,●:DC![]() )
)
⑸化合物AC与EC中熔点更高的是_________,原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态肼(N2H4)燃料电池被广泛应用于发射通讯卫星、战略导弹等运载火箭中。其中以固体氧化物为电解质,生成物为无毒无害的物质。下列有关该电池的说法正确的是
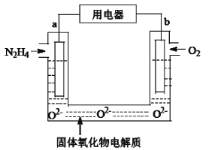
A.b极是正极,发生还原反应
B.电池电路中,电流方向:电极a→用电器→电极b
C.当电极a.上消耗1 mol N2H4时,电极b上被氧化的O2在标准状况下体积为11.2 L
D.b极附近的pH值变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d的原子序数依次增大,X、Y、Z均是由这些元素组成的二元化合物,它们存在转化关系:M![]() X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
X↑+Y↑+Z,组成化合物X的原子个数比为1:3,且液态X常用作制冷剂,Y的排放是形成酸雨的主要原因,且Y的组成元素位于同一主族且原子序数相差8,常温常压下Z为无色液体。下列说法错误的是( )
A.原子半径:d>b>c>a
B.b的最低价氢化物能使湿润的蓝色石蕊试纸变红
C.M既能与强酸溶液反应,又能与强碱溶液反应
D.b2c5、dc3均为酸性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com