
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A. Mg2C3水解生成丙炔B. Al4C3水解生成丙炔
C. ZnC2水解生成乙烷D. Li2C2水解生成乙烯
【答案】A
【解析】
CaC2制C2H2的反应方程式为CaC2+2H2O→Ca(OH)2+C2H2↑,该反应中各元素化合价不变,相当于发生复分解反应,只要碳化物中碳元素化合价在反应前后不变即可,据此分析解答。
A.Mg2C3水解生成丙炔的反应中碳元素反应前后化合价都是-![]() ,所以C元素化合价不变,产物正确,故A正确;
,所以C元素化合价不变,产物正确,故A正确;
B.Al4C3水解生成丙炔的反应中C元素化合价由-4价变为-![]() 价,C元素化合价发生变化,其产物应该是甲烷,故B错误;
价,C元素化合价发生变化,其产物应该是甲烷,故B错误;
C.ZnC2水解生成乙烷的反应中C元素化合价由-1价变为-3价,元素化合价发生变化,所以其产物不正确,其产物应该是C2H2,故C错误;
D.Li2C2水解生成乙烯的反应中C元素化合价由-1价变为-2价,C元素化合价发生变化,其产物应该是乙炔,故D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】煤的液化可以合成甲醇。
①“气化”:C(s)+2H20(g)=C02(g)+2H2(g) △H1=+90.1kJ·mol-1
②催化液化Ⅰ:CO2(g)+3H2(g)=CH30H(g)+H20(g)△H2=-49.0kJ·mol-1
③催化液化Ⅱ:C02(g)+2H2(g)=CH30H(g)+1/2O2(g)△H3=akJ·mol-1
下列有关说法正确的是

A. 催化液化Ⅰ中使用催化剂,反应的活化能Ea、△H2都减小
B. 反应C(s)+H20(g)+H2(g)=CH3OH(g) △H=+41.1kJ·mol-1
C. △H2>△H3
D. 甲醇燃料电池的工作原理示意图如图所示,负极的电极反应为CH3OH-6e-+6OH-=CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制乙烯并检验其性质的装置图,请回答:

(1)写出圆底烧瓶中反应的方程式______________________________;
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:____________________________________________;
(3)为了检验乙烯的生成及乙烯的不饱和性,试管中应盛放_________,现象为___________;
(4)洗瓶中盛放的试剂为____________________,作用__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_______.
(2)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______g(用分式表示)
(3)将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为________.
(4)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________.
(5)将50mL0.1molL1NaCl和50mL0.5molL1CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl)为_______.
(6)三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl和SO42,则n(SO42)为_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
A | B | C | D | |
实验 | 制取少量纯净的CO2气体 | 用CCl4提取溴水中的Br2 | 除去CO2中少量的HCl | 蒸干NaCl饱和溶液制备NaCl晶体 |
装置或仪器 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨的性质与水相似。T ℃时,NH3+NH3![]() NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
NH4 ++NH2-,NH4+的平衡浓度为1×10-15 mol·L-1,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-14
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是____(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料红氧化铁的工艺流程如下(部分操作和条件略):
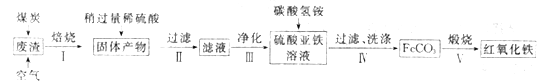
①在步骤Ⅰ中产生的有毒气体可能有_____________________。
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+ 沉淀完全,则溶液的pH为_________。(c(Al3+)≤1.0×10-5mol/L 视为Al3+沉淀完全)
③步骤Ⅳ中,生成FeCO3的离子方程式是____________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式______________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:__________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应Ⅱ的离子方程式是____________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN-,方案如下:
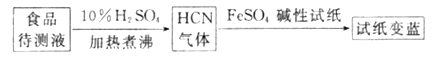
若试纸交蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用如图所示装量制取少量澳苯并证明该反应是取代反应。请回答:
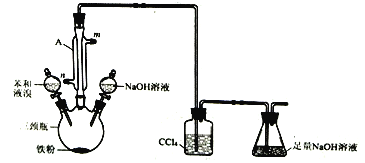
(1)仪器A的名称为____________,冷凝水的进水口为_________,(填“m”或“n”)。
(2)制取溴苯的化学方程式为___________________。
(3)锥形瓶中足量NaOH溶液的作用是_________。
(4)从实验安全的角度分析,该实验装置存在一处明显的缺陷请指出_________。
(5)反应结束后向三颈瓶中滴加氢氧化钠溶液,充分振荡,然后用__________(填仪器名称)分离出溴苯(仍含有少量苯)。
(6)设计实验证明制取溴苯的反应是取代反应___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com