
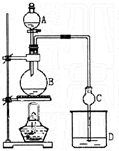
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示. 已知①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH;②有关有机物的沸点如下表:| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
 CH3CO18OCH2CH3+H2O.
CH3CO18OCH2CH3+H2O.分析 (1)乙酸与乙醇的酯化反应是可逆反应,反应中通常加入过量的乙醇,提高乙酸的转化率;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;
(3)根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,反应掉挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,故D中的溶液为饱和的碳酸钠溶液,碳酸根水解,溶液呈碱性,反应后溶液分层,上层无色油体液体,由于碳酸钠与乙酸反应,故下层溶液颜色变;
(4)用氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物;不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解.
解答 解:(1)乙酸与乙醇的酯化反应是可逆反应,乙醇相对廉价,加入过量的乙醇,增大反应物浓度,使平衡向正反应方向移动,提高乙酸的转化率,
故答案为:增加一种反应物,有利于酯化反应正向进行;
(2)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH218OH  CH3CO18OCH2CH3+H2O,
CH3CO18OCH2CH3+H2O,
故答案为:CH3COOH+CH3CH218OH  CH3CO18OCH2CH3+H2O;
CH3CO18OCH2CH3+H2O;
(3)乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,用球形干燥管,除起冷凝作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用,碳酸根离子水解:CO32-+H2O?HCO3-+OH-,溶液呈碱性,加入几滴酚酞,溶液呈红色,乙酸乙酯不溶于饱和碳酸钠溶液,密度比水小,溶液分层,上层无色油体液体,乙酸和碳酸钠反应而使溶液红色变浅,
故答案为:冷凝、防倒吸;CO32-+H2O?HCO3-+OH-;溶液分层,上层为无色油状液体,下层溶液颜色由红色变为无色(或变浅);
(4)加入无水氯化钙除去少量乙醇,用无水硫酸钠除去少量的水,无水硫酸钠吸水形成硫酸钠结晶水合物,不能选择P2O5、碱石灰和NaOH等固体干燥剂,以防乙酸乙酯在酸性(P2O5遇水生成酸)或碱性条件下水解,
故答案为:乙醇;C.
点评 本题考查乙酸乙酯的制备与实验改进,题目难度中等,注意掌握乙酸乙酯的制取原理及装置选择,明确反应过程中浓硫酸、饱和碳酸钠溶液的作用,试题有利于提高学生的分析、理解能力及化学实验能力.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子键就是阴阳离子间强烈的静电作用 | |
| B. | H和Cl形成的分子中存在的是极性共价键 | |
| C. | 氯化铵中没有金属元素,所以不是离子化合物 | |
| D. | 11号与9号元素能够形成离子化合物,该化合物中存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含有C、H两种元素 | |
| B. | 只含有C、O两种元素 | |
| C. | 含有C、H、O三种元素 | |
| D. | 一定含有C、H两种元素,不能确定是否含有O元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉露置在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 向滴有酚酞的硅酸钠溶液中边加边振荡地滴加盐酸至红色变浅并接近消失:2H++SiO32-═H2SiO3(胶体) | |
| C. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O═2SO32-+4Cl-+6H+ | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.1mol/LNa2SO4溶液中含有的Na+数是0.2×6.02×1023 | |
| B. | 0.5molMg变成Mg2+时失去的电子数是6.02×1023 | |
| C. | 常温常压下,16gO2中含有的原子数是6.02×1023 | |
| D. | NO的摩尔质量与6.02×1023个NO分子的质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若溶液呈中性,则c(K+)=c(CH3COO-) | |
| B. | 若溶液呈碱性,则c(K+)>c(CH3COO-) | |
| C. | 若溶液呈酸性,则c(H+)>c(CH3COO-)>c(K+) | |
| D. | 溶液呈电中性,则c(H+)+c(K+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,可能存在CH3COOH分子 | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7 mol/L | |
| D. | 在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 戊二醛的消毒原理与漂白粉、臭氧等消毒剂相同 | |
| B. | 1 mol 戊二醛分子可被1 mol Cu(OH)2完全氧化 | |
| C. | CH3CH═CHCH2COOH与戊二醛互为同分异构体 | |
| D. | 10g戊二醛完全燃烧需消耗0.6 mol O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com