
| A. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| B. | 0.1mol•L-1的Na2CO3溶液:K+、Ba+、NO32-、Cl- | |
| C. | 0.1mol•L-1的FeCl3溶液:K+、NH4+、I-、SCN- | |
| D. | c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
分析 A.碱溶液中该组离子之间不反应;
B.离子之间结合生成沉淀;
C.离子之间结合生成络离子,离子之间发生氧化还原反应;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性.
解答 解:A.碱溶液中该组离子之间不反应,则离子大量共存,故A正确;
B.Ba2+、CO32-结合生成沉淀,不能大量共存,故B错误;
C.Fe3+、SCN-结合生成络离子,I-、Fe3+发生氧化还原反应,不能大量共存,故C错误;
D.c(H+)/c(OH-)=1×1014的溶液呈酸性,酸性条件下ClO-不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应的离子共存及分析与应用能力的考查,题目难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | “化学纯”是指这种硫酸只含H2SO4和H2O分子 | |
| D. | 配制460mL2.3mol•L-1的稀硫酸需量取该硫酸62.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
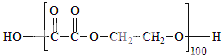 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)
某校课外实验小组同学设计如图装置进行实验.(夹持装置已略去)| 制取的气体 | 药品 | 化学方程式 |
| O2 | H2O2MnO2 | 2H2O2═2H2O+O2↑ |
| H2 | 某溶液、Al | 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ |
| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
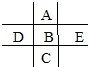 如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题:
如图为周期表前四周期的一小部分,A、B、C、D、E的位置关系如图所示.其中B元素的最高价是负价绝对值的3倍,它的最高氧化物中含氧60%,回答下列问题: .A单质的电子式为
.A单质的电子式为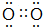 .
.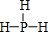 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
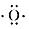 ;D原子的结构示意图
;D原子的结构示意图 .
. ,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.
,A、C、D形成的化合物中的化学键类型有离子键和共价键,B和C形成的化合物BC2的结构式O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 取一定量的废水样品,经测定其中有n(Cu2+)=0.01mol,n(Fe2+)+n(Fe3+)=0.01mol,则该水样中0mol≤n(Cl-)≤0.05mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4mL恰好完全反应,然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.16g,则废水中c(Fe3+)=0.01 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com