
【题目】在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。
2AB(g) △H<0,反应中各物质的浓度随时间的变化情况如图所示。

(1)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在图中画出4min~5min的AB浓度的变化线__________。
(2)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol。则反应向_________反应方向进行(填“正”或“逆”)。判断依据是_______。反应达到平衡后,各物质的体积分数与原平衡相比_______(填序号)。
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
【答案】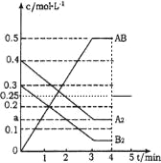 正 Qc<K ③
正 Qc<K ③
【解析】
(1)第4min时,若把容器的体积快速扩大一倍,瞬间AB的浓度变为原来的一半,该反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,据此作图;
(2)根据图像可知,分析判断平衡时各物质的浓度计算平衡常数K,再计算判断浓度商Qc与 K的大小关系,判断反应的方向;若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,据此分析解答。
(1)上述反应达到平衡后,第4min时,若把容器的体积快速扩大一倍,瞬间AB的浓度变为原来的一半,该反应前后气体体积不变,压强只改变反应速率,不改变平衡移动,4min~5min的AB浓度的变化线为: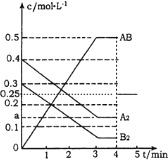 ,故答案为:
,故答案为: ;
;
(2)根据图可知,平衡时AB的浓度变化为0.5mol/L,则A2的浓度变化为0.25mol/L,所以a=0.4mol/L-0.25mol/L=0.15mol/L,平衡时B2的浓度为0.3mol/L-0.25mol/L=0.05mol/L,平衡常数K=![]() =
=![]() =
=![]() ,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,浓度商Qc=
,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,浓度商Qc=![]() =
=![]() <K=
<K=![]() ,反应向正反应进行,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,恒温恒容下,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,反应达到平衡后,各物质的体积分数与原平衡相比均不变,故答案为:正;浓度商Qc<K;③。
,反应向正反应进行,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.7mol、0.5mol、0.2mol,等效为开始加入0.8mol的A2气体和0.6molB2气体,恒温恒容下,与原平衡为完全等效平衡,平衡时相同组分的物质的量浓度相等,反应达到平衡后,各物质的体积分数与原平衡相比均不变,故答案为:正;浓度商Qc<K;③。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2)。
(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式________;
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阳极的电极反应式________;
(3)某课题组用上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其它少量不溶于稀酸的物质)为原料,设计如图流程对资源进行回收,得到Ce(OH)4和硫酸铁铵。

①过滤得到滤渣B时,需要将其表面杂质洗涤干净。洗涤沉淀的操作是________。
②反应①的离子方程式为______________________。
③如下图,氧化还原滴定法测定制得的Ce(OH)4产品纯度。
![]()
该产品中Ce(OH)4的质量分数为________________(保留两位有效数字)。若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度__________ (“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试剂瓶上贴有如下标签,对该试剂理解正确的是
![]()
A. 该溶液中含有的微粒主要有:NaCl、Na+、Cl-、H2O
B. 若取50毫升溶液,其中的c(Cl-)=0.05 mol/L
C. 若取该溶液与0.1 mol/L AgNO3 100 mL溶液完全反应,需要取该溶液10 mL
D. 该溶液与1.0mol/LNa2SO4溶液的c(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期中五种元素A,B,C,D,E原子序数依次增大,其中A,B,C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为nsnnpn+1,A原子的最外层电子数等于其电子层数.D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B,C,D,E四种元素的原子,半径从大到小的顺序是__(填元素符号或化学式,下同);第一电离能从大到小的顺序是__
(2)C原子的电子排布图__,D2﹣的结构示意图__.A,D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出该化合物的结构式__,分子中含有__键(填“极性”或“非极性”,下同)是__分子.
(3)A,B,D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物.试写出它的电子式__,根据价层电子对互斥(VSEPR)理论推测该分子中心原子的杂化方式为__杂化,空间构型为__.
(4)C和E形成一种离子化合物Y,其摩尔质量为65g/mol,Y受热或撞击时立即分解为两种单质.则Y的化学式为__,Y的阴离子是一种弱酸根离子,全由C元素组成,Y与盐酸反应的离子方程式为__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是

A. 放电时,正极的电极反应式为Fe2O3+6Li++6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe作电池的负极,Fe2O3作电池的正极
D. 充电时,电池被磁铁吸引
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中甲、乙、丙表示某动物细胞中的不同化合物,下列叙述正确的是( )

A. 核糖核苷酸是构成物质甲的基本单位
B. 物质甲为该生物的主要遗传物质
C. 物质丙是构成细胞的基本骨架
D. 物质乙的种类和数量与细胞膜的功能密切相关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,在200 mL氢氧化钡溶液中含有1×10-3mol的钡离子,将此溶液与pH=3的盐酸混合,使其混合溶液的pH=7,应取氢氧化钡溶液和盐酸的体积之比是_________。
(2)25℃时,利用pH试纸测得0.1molL-1醋酸溶液的pH约为3,则可以估算出醋酸的电离常数约为_______;向10mL此溶液中加入少量冰醋酸,忽略溶解过程中溶液温度和体积的微小变化,溶液中c(H+)/c(CH3COOH)的值将_____(填“增大”、“减小”或“无法确定”)。
(3)25 ℃时,pH=3的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=______(取近似值)
(4)室温时,向100mL0.1mol·L-1NH4HSO4溶液中滴加0.1mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示:试分析图中a、b、c、d四个点,水的电离程度最大的是________点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g) ![]() 2C(g) ΔH<0,达到平衡时,下列说法正确的是
2C(g) ΔH<0,达到平衡时,下列说法正确的是
A. 加入催化剂,B的转化率增大 B. 减小容器体积,平衡不移动
C. 增大c(A),A的转化率增大 D. 降低温度,v正 增大,v逆 减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com