

图1 图2
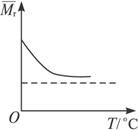
图3
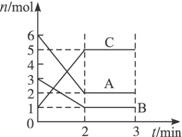
A.前2 min C的平均反应速率为1 mol·L-1·min-1
B.该反应的化学方程式为:2A+B![]() 2C
2C
C.正反应是放热反应
D.A、B一定均为气态
科目:高中化学 来源:北京市大兴区2011届高三二模理综化学试题 题型:058
短周期元素A、B、C、D、E、F、G其核外电子总数依次增多,A原子是元素中电子总数最少的,B的最外层电子数是次外层电子数的二倍,C最外层电子数是其电子层数的三倍,G与C同族且两元素核外电子总数之和与D、E两元素核外电子总数之和相等,F的最外电子数是次外层电子数的二分之一.
(1)、写出元素F在周期表中的位置________.
(2)、由元素ABC组成的18电子物质,是假酒中常见的有毒物质之一,其电子式为________.
(3)、已知这样两反应G(s)+C2(g) GC2(g) ΔH1=-296 KJ·mol-1,2GC3(g)
GC2(g) ΔH1=-296 KJ·mol-1,2GC3(g) 2GC2(g)+C2(g) ΔH2=+198 KJ·mol-1
2GC2(g)+C2(g) ΔH2=+198 KJ·mol-1
则2G(s)+3C2(g) 2GC3(g) ΔH3=________.
2GC3(g) ΔH3=________.
(4)、对于可逆反应:2GC2(g)+C2(g)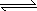 2GC3(g) ΔH=a KJ·mol-1图中两条曲线分别表示温度为T1和T2时体系中GC3的百分含量和时间的关系.
2GC3(g) ΔH=a KJ·mol-1图中两条曲线分别表示温度为T1和T2时体系中GC3的百分含量和时间的关系.
GC3%
T1时平衡常数K1、T2时平衡常数K2,则K1________K2(>、<、=).
T2时在2 L密闭容器中充入4 moL GC2和3 moL C2,在一定条件下达到平衡时GC2的转化率为90%,则这时的平衡常数数值是________.
(5)、D2FC3溶液与E2(GC4)3溶液混合产生两种匀溶于DCA溶液的难溶物质,写出两溶液混合所发生的离子反应方程式________.
(6)向Ba(AGC3)2溶液中滴加足量A2C2产生23.3克白色沉淀时,反应中电子转移总数物质的量为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)B的平衡浓度为____________________。
(2)A的转化率为______________________。
(3)生成D的反应速率为____________________。
(4)如果缩小反应容器的体积,使压强增大,平衡体系中C的物质的量的浓度__________,C的质量分数__________,容器内气体的平均密度____________________,平均相对分子质量____________________。(均填“增大”“减小”或“不变”)
(5)如果上述反应在相同条件下从逆反应开始进行,开始加C和D各4/3 mol,要使平衡时各物质的质量分数与原平衡相等,则还应加入__________物质__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
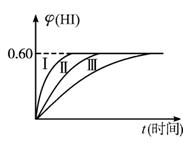
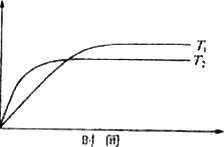
图1-2-9
(1)达到平衡时,I2(g)的物质的量浓度为___________mol·L-1。
(2)若改变反应条件,在甲条件下φ(HI)的变化如图中曲线(Ⅰ)所示,在乙条件下φ(HI)的变化如图中曲线(Ⅲ)所示,则甲条件可能是___________,乙条件可能是___________ (填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下降低温度
③恒温条件下,缩小反应容器的体积
④恒温条件下,扩大反应容器的体积
⑤恒温、恒容条件下,加入适当催化剂
(3)若保持温度不变,在另一相同的2 L密闭容器中加a mol I2(g),b mol H2和c mol HI(a,b,c均大于0),发生反应达到平衡时,HI的体积分数仍为0.60,则a,b,c的关系是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)在一定温度下的2 L密闭容器中充入0.4 molSO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH <0,n(O2)随时间的变化如图实线所示:
(1)用SO2表示0~4 min内该反应的平均速率为 。该温度下反应的平衡常数K为 。升高温度K值 (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),SO3的体积分数 (填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
查看答案和解析>>
科目:高中化学 来源:2013届江西省高二第一次月考化学试卷 题型:填空题
(12分)在一定温度下的2 L密闭容器中充入0.4 mol
SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g)  2SO3(g)
ΔH <0,n(O2)随时间的变化如图实线所示:
2SO3(g)
ΔH <0,n(O2)随时间的变化如图实线所示:
(1)用SO2表示0~4 min内该反应的平均速率为 。该温度下反应的平衡常数K为 。升高温度K值 (填“增大”、“不变”或“减小”)。
(2)若温度不变,在容器中再加1 mol O2 ,重新达到平衡,则SO2的平衡浓度
(填“增大”、“不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),SO3的体积分数 (填“增大”、“不变”或“减小”)。
(3)仅改变某一实验条件再进行两次实验,测得O2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是_____________________________,曲线II对应的实验条件改变是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com