
| 事实 | 结论或推测 | |
| A | Na与冷水激烈反应,生成H2 | Mg与沸水迅速反应,生成H2 |
| B | F2与H2暗处剧烈化合,生成的HF很稳定 | I2与H2加热也能化合,生成的HI也很稳定 |
| C | Na与O2加热反应生成Na2O2 | IA元素单质与O2加热反应均生成过氧化物 |
| D | H3PO4是中强酸,As是P的同主族非金属元素 | H3AsO4是强酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.钠的金属性比镁强,金属性越强,越易与水反应;
B.HI不稳定,易分解;
C.Li与氧气反应只生成Li2O;
D.元素的非金属性越强,对应的最高价氧化物的水化物越强.
解答 解:A.金属性Na>Mg,金属性越强,越易与水反应,Na与冷水激烈反应,生成H2,则镁与水反应不如钠剧烈,可与热水反应,故A正确;
B.非金属性F>I,HF很稳定,但HI不稳定,易分解,故B错误;
C.Li与氧气反应只生成Li2O,故C错误;
D.非金属性P>As,元素的非金属性越强,对应的最高价氧化物的水化物越强,H3PO4是中强酸,As是P的同主族非金属元素,H3AsO4是弱酸,故D错误.
故选A.
点评 本题综合考查元素周期率以及化学实验方案的评价,为高频考点,侧重考查学生的分析能力,注意把握物质的性质以及元素周期率的递变规律,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | n(CO2)=0.1时,c(Na+)>c(AlO2-)>c(CO32-)>c(OH-) | |
| B. | 0.1mol<n(CO2)<0.15时发生的反应是:Na2CO3+CO2+H2O═2NaHCO3 | |
| C. | n(CO2)=0.15时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| D. | n(CO2)=0.3时,c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.6mol/L | B. | 3.2mol/L | C. | 2.8mol/L | D. | 2.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
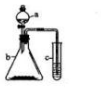 利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )
利用右下图所示的装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测c中现象正确的是( )| 选项 | a | b | c | c试管中的现象 |
| A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
| B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
| C | 饱和NaCl | CaC2 | 硫酸铜溶液 | 产生蓝色沉淀 |
| D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)2CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中用饱和食盐水除去氯气中的氯化氢气体 | |
| B. | 实验室中久置的浓氨水碱性减弱 | |
| C. | 向硝酸亚铁溶液中滴加盐酸,溶液变为黄色 | |
| D. | 在较高温度下测定二氧化氮气体相对分子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| B | 鉴别KBr溶液和KI溶液 | 分别加入新制氯水,再加入CCl4振荡、静置,观察 |
| C | 配制100mL 1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| D | 除去CuO中混有的Al2O3 | 加入过量盐酸溶液后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com