
【题目】下列电离方程式书写正确的是
A. NaHCO3![]() Na+ + HCO3-
Na+ + HCO3-
B. CaCO3 = Ca2+ + CO32-
C. Cu(NO3)2 = Cu2+ + (NO3-)2
D. HClO = H+ + ClO-
【答案】B
【解析】
强电解质在水溶液中完全电离,书写电离方程式时用“=”。
弱电解质在水溶液中发生部分电离,书写电离方程式时用“”。
A. NaHCO3为强电解质在水溶液中完全电离,电离方程式为NaHCO3 =Na+ + HCO3-,HCO3- H+ + CO32-,A错误。
B. CaCO3为强电解质在水溶液中完全电离,电离方程式为CaCO3 = Ca2+ + CO32-,B正确。C. Cu(NO3)2为强电解质在水溶液中完全电离,电离方程式为Cu(NO3)2 = Cu2+ + 2NO3-,C错误。
D. HClO为弱电解质在水溶液中发生部分电离,电离方程式为HClO H+ + ClO-,D错误。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】下列哪一个反应表示二氧化硫被还原 ( )
A.SO2+2H2O+Cl2=H2SO4+2HCl
B.SO2+2H2S=2H2O+3S
C.SO2+2NaOH=Na2SO3+H2O
D.SO2+Na2CO3=Na2SO3+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种有机物A和B可以互溶,有关性质如下:
相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
A | 0.7893 | -117.3℃ | 78.5℃ | 与水以任意比混溶 |
B | 0.7137 | -116.6℃ | 34.5℃ | 不溶于水 |
(1)若要除去A和B的混合物中少量的B,可采用_______(填代号)方法即可得到A。
a.重结晶 b.蒸馏 c.萃取 d.加水充分振荡,分液
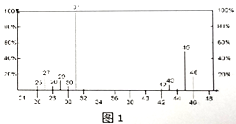
(2)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的最简式为_________,若要确定其分子式,是否必需有其它条件_______(填“是”或“否“),已知有机物A的质谱、核磁共振氢谱如图1所示,则A的结构简式为________。
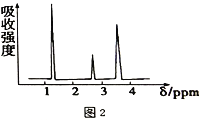
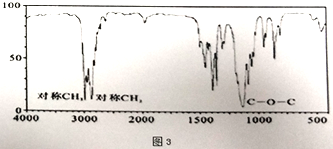
(3)若质谱图2显示B的相对分子质量为74,红外光谱如图3所示,则B的结构简式为_________,其官能团的名称为_________。
(4)准确称取一定质量的A和B的混合物,在足量氧气中充分燃烧,将产物依次通过足量的无水氯化钙和碱石灰,发现质量分别增重19.8g和35.2g.计算混合物中A和B的物质的量之比_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种含氧杂环化合物,在合成有机材料和药品中有重要应用、其结构如下图所示。下列关于该有机物的说法不正确的是

A. 1mol该有机物最多能消耗4mol NaOH
B. 1mol该有机物与H2反应时,最多消耗6mol H2
C. 该有机物的苯环上的一氯代物有3种
D. 该分子所有原子可能处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需用490 mL 0.5 mol·L-1的CuSO4溶液。
(1)该同学应选择________ mL的容量瓶。
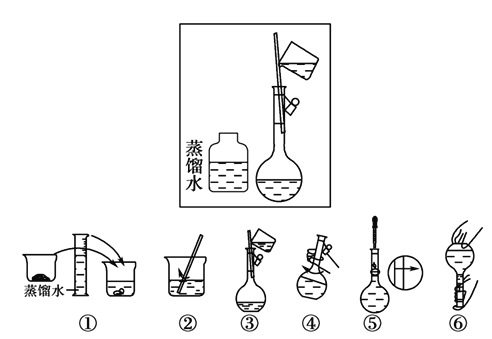
(2)某操作步骤如下图方框所示,则该图表示的操作应放在下图序号所示的_______和_______(填序号)操作之间。
(3)实验室可以提供三种试剂:①CuSO4固体②CuSO·5H2O ③10mol·L-1CuSO4溶液,若该同学用②来配制上述所需CuSO4溶液,应称取试剂②的质量是___________;若该同学用③来配制上述所需CuSO4溶液,应量取试剂③的体积是____________。
(4)下列溶液配制过程中能造成浓度偏低的操作有(填写序号)_________。
a.转移完溶液后未洗涤玻璃棒和烧杯
b.容量瓶用蒸馏水洗涤后残留有少量的水
c.用CuSO固体配制溶液,称量时发现部分固体颜色变蓝
d.进行(2)中图②操作时有部分液体溅到烧杯外边
e.定容时俯视刻度线
f.摇匀后发现液面低于刻度线,没进行其他操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向25mL0.1molL-1NaOH溶液中逐滴滴加0.2molL-1的一元酸HX溶液,pH的变化曲线如下图所示(溶液混合时体积的变化忽略不计).下列说法正确的是( )
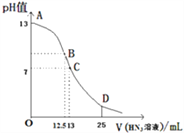
A. 在B点,离子浓度大小为c(OH-)>c(H+)>c(Na+)>c(X-)
B. D点的溶液中c(H+)+c(HX)=c(X-)+c(OH-)
C. HX是弱酸,常温下其电离常数Ka=2.5×10-6
D. D点的溶液中有c(HX)-2c(H+)=2c(OH-)+c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分利用铜资源,某工厂利用废旧黄铜灰(含有Cu、Zn、CuO、ZnO及少量的FeO、Fe2O3、SiO2等)制取金属铜并得副产物锌盐,其生产流程如下:
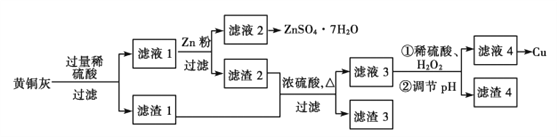
(1)滤渣1的主要成分为__________。稀硫酸溶解黄铜灰过程中,Cu是否参与了反应,如果参与请写出该反应的离子反应方程式,如果没反应请写出理由:_____________________。
(2)滤渣1及滤渣2与浓硫酸反应的步骤中存在缺陷,可将实验改进为先让滤渣与_______反应,产物再溶于稀硫酸,这样改进的优点是_____________________________________。
(3)写出滤液3与H2O2反应的离子反应方程式____________________________________,滤液3反应中需要调节PH的目的是______________________________________________。
(4)25 ℃时,沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)关系如下图所示。
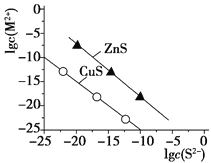
则Ksp(CuS)=_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测测定水中溶解氧的方法是:
①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液(含KOH),立即塞好瓶塞,反复振荡,使之充分反应,其反应式为:2Mn2++O2+4OH-===2MnO(OH)2(该反应极快)。
②测定:开塞后迅速加入1~2 mL浓硫酸(酸化,提供H+),使之生成I2,再用b mol/L的Na2S2O3溶液滴定(以淀粉为指示剂),消耗V mL。有关反应式为:MnO(OH)2+2I-+4H+===Mn2++I2+3H2O、I2+2S2O![]() ===2I-+S4O
===2I-+S4O![]() 。
。
试回答:
(1)滴定过程中用到的玻璃仪器除了酸式滴定管、碱式滴定管外还缺少_____________。
(2)滴定操作时,左手控制滴定管,右手________,眼睛要注视________。
(3)水中溶解氧的计算式是______(以g/L为单位)。
(4)滴定(I2和S2O![]() 反应)以淀粉为指示剂,终点时溶液由________色变为________色,且半分钟内不褪色。
反应)以淀粉为指示剂,终点时溶液由________色变为________色,且半分钟内不褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. 铜棒的质量 B. c(Zn2+) C. c(H+) D. c(SO42-) -
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com