
甲柜 | 乙柜 | 丙柜 | 丁柜 | 戊柜 |
盐酸、硫酸 | 烧碱、氢氧化钡 | 硫、红磷 | 铜、锌 | 碳酸钠、硝酸钾 |
现在新购进硝酸、苛性钾、碘和硝酸银溶液,下列对其保存方法不正确的是( )
A.硝酸装进棕色细口瓶放在甲柜 B.苛性钾固体用磨口玻璃塞广口瓶放在乙柜
C.碘单质用广口瓶装放在丙柜 D.硝酸银溶液用棕色磨口细口瓶放在戊柜
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | 实验操作 | 实验现象 |
| ① | 滴入KSCN溶液 | 溶液变红色 |
| ② | 滴入AgNO3溶液 | 有黄色沉淀生成 |
| ③ | 滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| ④ | 滴入淀粉溶液 | 溶液变蓝色 |
| A. | ②和④ | B. | ①和③ | C. | ③和④ | D. | ① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙苯(
乙苯(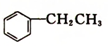 )在有机合成中占有重要的地位,有着广泛的用途.
)在有机合成中占有重要的地位,有着广泛的用途. (g)+HCl(g)?
(g)+HCl(g)? (g)△H1=-54kJ•mol-1
(g)△H1=-54kJ•mol-1 (g)+H2(g)?
(g)+H2(g)? (g)△H2=-121kJ•mol-1
(g)△H2=-121kJ•mol-1| 化学键 | C-H | C-C | C=C | C-Cl | H-Cl |
| 键能/(kJ•mol-1) | 412 | 348 | X | 341 | 432 |
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H4
(g)+HCl(g)△H4 (g)、2mol Cl2(g)、1mol
(g)、2mol Cl2(g)、1mol  (g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.
(g)、2mol HCl(g),则开始时,v正=(填“>”、“<”或“=”)v逆.查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省成都市高一上10月月考化学试卷(解析版) 题型:选择题
A实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室
B在气体发生装置上直接点燃一氧化碳气体时,必须要先检验一氧化碳气体的纯度.最简单的方法是用排空气的方法先收集一试管气体,点燃气体,听爆鸣声
C 制氧气时排水法收集氧气后出现倒吸现象,应立即松开试管上的橡皮塞
D凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S$\stackrel{O_{2}}{→}$SO2$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | Al3+$\stackrel{过量氨水}{→}$AlO${\;}_{2}^{-}$$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| C. | NaCl(aq)$\stackrel{电解}{→}$Na$\stackrel{O_{2}}{→}$Na2O2 | |
| D. | Fe$\stackrel{稀H_{2}SO_{4}}{→}$FeSO4(aq) $\stackrel{NaOH(aq)}{→}$Fe(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在光分解催化剂存在下,利用太阳能分解水制H2 | |
| B. | 以焦炭和水为原料制水煤气后再分离出H2 | |
| C. | 以金属钠与水反应生成H2 | |
| D. | 由热电站提供电力电解水产生H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
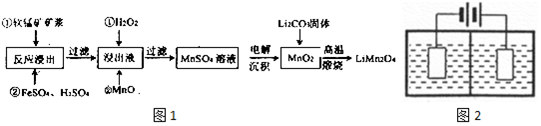
| 物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
| Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com