
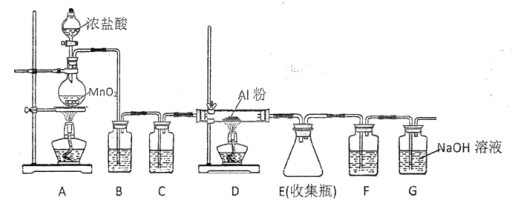
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如图所示。
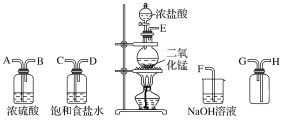
(1)连接上述仪器的正确顺序(填各接口处的字母):__接__;__接__;__接___;__接__。
(2)装置中,饱和食盐水的作用是___;NaOH溶液的作用是___。
(3)化学实验中常用湿润的KI-淀粉试纸检验是否有Cl2产生。如果有Cl2产生,可观察到___,反应的化学方程式为___。
(4)写出下列反应的化学方程式:
①气体发生装置中进行的反应:___。
②NaOH溶液中发生的反应:___。
【答案】E C D A B H G F 除去氯气中的HCl杂质 吸收过量的氯气 吸收过量的氯气 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 2NaOH+Cl2=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O 2NaOH+Cl2=NaCl+NaClO+H2O
【解析】
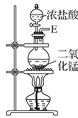 为氯气的制备装置,装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,浓盐酸具有挥发性,选用装置
为氯气的制备装置,装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,浓盐酸具有挥发性,选用装置 除去氯气中混有的氯化氢,选用装置
除去氯气中混有的氯化氢,选用装置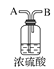 干燥氯气,氯气的密度比空气大,选用装置
干燥氯气,氯气的密度比空气大,选用装置![]() 从H口通入收集氯气,氯气有毒,选用装置
从H口通入收集氯气,氯气有毒,选用装置![]() 吸收氯气,防止污染环境。
吸收氯气,防止污染环境。
(1)制备干燥纯净的氯气,实验装置的连接顺序为:发生装置→除杂装置→干燥装置→收集装置→尾气处理装置,注意除杂装置中长导管进气,短导管出气,氯气的密度大于空气,收集时应长导管进气短导管出气,则仪器连接的顺序为E—C—D—A—B—H—G—F,故答案为:E;C;D;A;B;H;G;F;
(2)氯气中混有氯化氢杂质,氯化氢能溶于饱和食盐水中,但是氯气不溶,可以用饱和食盐水除去氯气中的氯化氢气体;氯气有毒,NaOH溶液的作用是吸收过量的氯气,防止污染环境,故答案为:除去氯气中的HCl杂质;吸收过量的氯气;
(3)Cl2氧化KI生成碘,碘单质遇淀粉变蓝,故观察到的现象为试纸变蓝,反应的化学方程式为2KI+Cl2=2KCl+I2,故答案为:试纸变蓝;2KI+Cl2=2KCl+I2;
(4)①气体发生装置中二氧化锰和浓盐酸共热反应生成氯化锰、氯气和水,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②NaOH溶液与氯气反应生成氯化钠、次氯酸钠和水,反应的化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O。


 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室用需配制230mL 0.1mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)实际用托盘天平称Na2CO3质量______________;
(2)应选用容量瓶的规格为:_________,除容量瓶外还需要的其它仪器:______;
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)___________;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)
①若没有进行A操作_______________;
②若加蒸馏水时不慎超过了刻度_______________。
Ⅱ.实验室需配制250 mL 0.1 mol/L的醋酸(CH3COOH),现有36%的醋酸,密度为1.04g/mL,按要求回答下列问题:
(1)需要量筒取用36%的醋酸________ mL进行配制;
(2)若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度___________(填“正确”、“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应与酸性氧化物的通性无关的是( )
A. 存放NaOH的试剂瓶不用磨口玻璃塞B. ![]() 与水反应制备氧气
与水反应制备氧气
C. 烧煤时加入生石灰脱硫D. ![]() 与澄清石灰水作用
与澄清石灰水作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一块表面已被氧化成氧化钠的钠块(质量为5.4 g)投入足量的水中,产生标准状态下的H2 1.12 L,则原来被氧化的钠的质量为
A.5.3gB.4.6 gC.3.1 gD.2.3 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(![]() )是有机合成的重要还原剂,其合成线路如下图所示。
)是有机合成的重要还原剂,其合成线路如下图所示。
![]()
(1)无水![]() (
(![]() 升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
①![]() 中发生反应的化学方程式为__________________。
中发生反应的化学方程式为__________________。
②实验时应先点燃______(填“![]() ”或“
”或“![]() ”)处酒精灯,当观察到____________时,再点燃另一处酒精灯。
”)处酒精灯,当观察到____________时,再点燃另一处酒精灯。
③装置![]() 中盛放饱和NaCl溶液,该装置的主要作用是__________________,请结合方程式进行解释__________________。
中盛放饱和NaCl溶液,该装置的主要作用是__________________,请结合方程式进行解释__________________。
④![]() 中试剂的作用是__________________。用一件仪器装填适当试剂后也可起到
中试剂的作用是__________________。用一件仪器装填适当试剂后也可起到![]() 和
和![]() 的作用,所装填的试剂为__________________。
的作用,所装填的试剂为__________________。
(2)制取铝氢化钠的化学方程式是__________________。
(3)改变![]() 和
和![]() 中的试剂就可以用该装置制取NaH,NaH中氢元素化合价为______,若装置中残留有氧气,制得的NaH中可能含有的杂质为______。
中的试剂就可以用该装置制取NaH,NaH中氢元素化合价为______,若装置中残留有氧气,制得的NaH中可能含有的杂质为______。
(4)铝氢化钠遇水发生剧烈反应,其反应的化学方程式为____________。欲测定铝氢化钠粗产品(只含有NaH杂质)的纯度。称取![]() 样品与水完全反应后,测得气体在标准状况下的体积为
样品与水完全反应后,测得气体在标准状况下的体积为![]() ,样品中铝氢化钠的质量分数为______。(结果保留两位有效数字)
,样品中铝氢化钠的质量分数为______。(结果保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义。
(1)25 ℃,在0.10 mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与[S2-]关系如下图(忽略溶液体积的变化、H2S的挥发)。
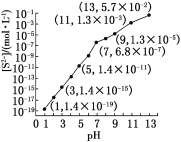
①pH=13时,溶液中的[H2S]+[HS-]=__________mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH=____________时,Mn2+开始沉淀[已知:Ksp(MnS)=2.8×10-13]。
(2)25 ℃,两种酸的电离平衡常数如下表。
物质 | Ka1 | Ka2 |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO的电离平衡常数表达式K=________。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为____________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式氯化铜是重要的无机杀菌剂。
(1)碱式氯化铜有多种制备方法
①方法1: 45 ~ 50℃时,向CuCl悬浊液中持续通入空气得到Cu2 (OH)2 Cl2·3H2O, 该反应的化学方程式为_________________________。
②方法2: 先制得CuCl2,再与石灰乳反应生成碱式氯化铜。Cu与稀盐酸在持续通入空气的条件下反应生成CuCl2,Fe3+对该反应有催化作用,其催化原理如图所示。 M'的化学式为______。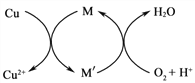
(2)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O。 为测定某碱式氯化铜的组成, 进行下列实验:
①称取样品1.1160 g,用少量稀HNO3溶解后配成100.00 mL溶液A;
②取25. 00 mL溶液A,加入足量AgNO3溶液,得AgCl 0. 1722 g;③另取25. 00 mL溶液A,调节pH 4 ~ 5,用浓度为0.08000 mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+ (离子方程式为Cu2++ H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液30.00 mL。通过计算确定该样品的化学式(写出计算过程)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于钠及其化合物性质的叙述,正确的是( )
A.钠的化学性质活泼,可以和![]() 溶液反应制取金属钛
溶液反应制取金属钛
B.氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同
C.过氧化钠是淡黄色固体,可用于呼吸面具中作为氧气的来源
D.![]() 与酸反应的剧烈程度强于
与酸反应的剧烈程度强于![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图2的碎纸片补充到图1中,可得到一个完整的氧化还原反应的离子方程式(未配平)。下列对该反应的说法不正确的是

A. IO4﹣作氧化剂
B. 若有1 mol Mn2+参加反应转移5mol电子
C. 还原剂与氧化剂的物质的量之比为2:5
D. 配平后H+、Mn2+的化学计量数分别为4、2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com