


 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L氢气中含有氢分子致目为NA |
| B、0.5mol Na2CO3中含有的Na+数目为0.5 NA |
| C、常温常压下,14g氮气含有的原子数目为NA |
| D、0.5 mol/L Fe2(SO4)3溶液中,S的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、114.8 kJ |
| B、232 kJ |
| C、368.8 kJ |
| D、173.4 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
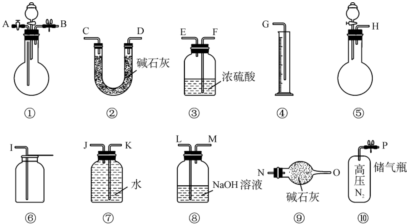
 某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).
某研究小组用下图装置进行SO2 与FeCl3溶液反应的相关实验(夹持装置已略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、200 ml |
| B、400 ml |
| C、450 ml |
| D、700ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气:K+ Ba2+ SiO32- NO3- |
| B、二氧化硫:Na+ NH4+ SO32- C1- |
| C、氨气:K+ Na+ AlO2- CO32- |
| D、甲醛:Ca2+ Mg2+ Mn04- NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com