
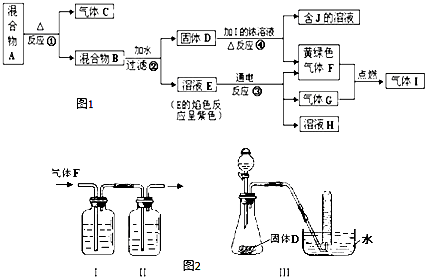
分析 F为黄绿色气体,则F为Cl2,E的溶液焰色反应为紫色,可以K元素,电解E的反应得到氯气,E为KCl,G为氢气,H为KOH,氢气与氯气反应生成I为HCl,反应③为二氧化锰与浓盐酸的反应,则D为MnO2,J为MnCl2,混合物B为MnO2、KCl的混合物,则反应①为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,A为KClO3、MnO2,气体C为O2.
解答 解:F为黄绿色气体,则F为Cl2,E的溶液焰色反应为紫色,可以K元素,电解E的反应得到氯气,E为KCl,G为氢气,H为KOH,氢气与氯气反应生成I为HCl,反应③为二氧化锰与浓盐酸的反应,则D为MnO2,J为MnCl2,混合物B为MnO2、KCl的混合物,则反应①为2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,A为KClO3、MnO2,气体C为O2.
(1)反应①的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑,
反应③的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-,
反应④的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑;2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH-;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)①要获得干燥纯净的黄绿色气体氯气,瓶Ⅰ中盛放饱和食盐水抑制氯气的溶解同时除去混有的HCl,在瓶Ⅱ中盛放浓H2SO4干燥即可,故答案为:饱和食盐水;除去Cl2中的HCl;
②用图III装置制取并证明气体C(氧气),过氧化氢再二氧化锰作催化剂条件下分解生成氧气,试管中收集满气体后,把导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气,
故答案为:H2O2;把导管移出水面,关闭分液漏斗活塞,用姆指堵住试管口,取出试管,立即把带火星的木条伸入试管口内,木条复燃,证明试管中收集的气体是氧气.
点评 本题考查无机物的推断、氯气的制备、实验方案设计与评价等,熟悉掌握元素化合物性质以及中学常见气体制备,难度中等.


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:选择题
| A. | 水分子的结构式是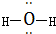 | |
| B. | NaCl的电子式为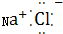 | |
| C. | 23Na37Cl中质子数和中子数之比是7:8 | |
| D. | 三氟化氮的电子式为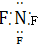 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
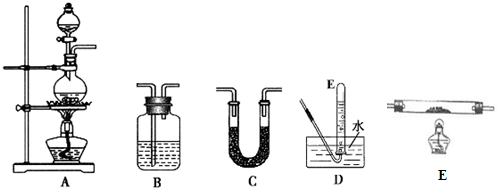
| 选用的仪器 | 加入的试剂 |
| A | 甲酸、浓硫酸 |
| D | -- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+浓度减小 | B. | 溶剂质量减小 | C. | 溶液质量不变 | D. | Ca2+数目增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁腐蚀时可能发生的正极反应为:2H2O+O2+4e-=4OH- | |
| B. | 向沸水中滴入几滴FeC13溶液:Fe3++3H2O=Fe(OH)3↓+3H+ | |
| C. | 1L0.5mol•L-1稀硫酸与1L1mol•L-1氢氧化钠溶液反应放出57.3kJ的热量: H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6kJ•mol-1 | |
| D. | 向KHSO4溶液中滴入Ba(OH)2溶液使pH=7:SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
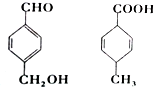
| A. | 均可以发生加成和取代反应 | |
| B. | 均能使酸性高锰酸钾溶液褪色 | |
| C. | 互为同分异构体 | |
| D. | 既能用红外光谱区分,也可以用核磁共振氢谱区分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol/(L•min) | |
| B. | 用B、C、D分别表示反应的速率,其比值是3:2:1 | |
| C. | 在2min末的反应速率用B表示是0.3 mol/(L•min) | |
| D. | 在这2min内用B和C表示的速率的值都是逐渐增大的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com