
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是
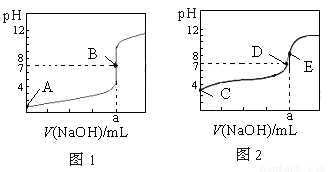
A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为c(A-)>c(Na+)>c(H+)>c(OH-)
C
【解析】
试题分析:A、滴定开始时0.1000mol/L盐酸pH=1,而0.1000mol/L醋酸pH>1,所以滴定盐酸的曲线是图1,故A不正确;B、达到B、E状态时,消耗的氢氧化钠物质的量是相等的,根据反应原理:HCl~NaOH,CH3COOH~NaOH,反应消耗的n(CH3COOH)=n(HCl),故B错误;C、达到B、D状态时,溶液是中性的,此时c(H+)=c(OH-),根据电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),则两溶液中离子浓度均为 c(Na+)=c(A-),故C正确;D、当0 mL<V(NaOH)<20.00 mL时,酸相对于碱来说是过量的,所得溶液是生成的盐和酸的混合物,假设当加入的氢氧化钠极少量时,生成了极少量的钠盐(氯化钠或是醋酸钠),剩余大量的酸,此时c(A-)>c(H+)>c(Na+)>c(OH-),故D错误,答案选C。
考点:考查NaOH与强酸、弱酸的反应,涉及盐类的水解和溶液离子浓度的大小比较知识


科目:高中化学 来源:2013-2014学年广东省广州市毕业班综合测试(二)理综化学试卷(解析版) 题型:填空题
苯乙烯是重要的基础有机原料。工业中用乙苯(C6 H5- CH2 CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6 H5- CH= CH2)的反应方程式为:
C6 H5- CH2 CH3 (g) C6 H5- CH=CH2 (g) +H2(g) ΔH1
C6 H5- CH=CH2 (g) +H2(g) ΔH1
(1)向体积为VL的密闭容器中充入a mol乙苯,反应达到平衡状态时,平衡体系组成(物质的量分数)与温度的关系如图所示:
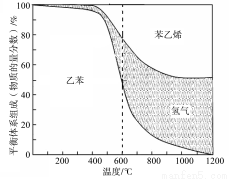
由图可知:在600℃时,平衡体系中苯乙烯的物质的量分数为25%,则:
① 氢气的物质的量分数为 ;乙苯的物质的量分数为 ;
② 乙苯的平衡转化率为 ;
③ 计算此温度下该反应的平衡常数(请写出计算过程)。
(2) 分析上述平衡体系组成与温度的关系图可知:△H1 0(填“>、=或<” )。
(3)已知某温度下,当压强为101.3kPa时,该反应中乙苯的平衡转化率为30%;在相同温度下,若反应体系中加入稀释剂水蒸气并保持体系总压为101.3kPa,则乙苯的平衡转化率 30%(填“>、=、<” )。
(4)已知:
3C2 H2 (g)  C6 H6 (g) ΔH2
C6 H6 (g) ΔH2
C6 H6 (g) + C2H4 (g)  C6 H5- CH2CH3 (g) ΔH3
C6 H5- CH2CH3 (g) ΔH3
则反应3C2H2 (g) + C2H4 (g)  C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
C6 H5- CH=CH2 (g) +H2(g) 的ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省文登市高三第三次统考理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、W 属于同周期的短周期主族元素,原子序数依次增大,它们的原子最外层电子数之和为17,且Y原子最外层电子数是X原子最外层电子数的3倍,W的内层电子数比最外层电子数多。下列说法正确的是
A.原子半径大小:r(X)>r(Y);简单离子半径大小:r(W)>r(Z)
B.X、Y、Z最高价氧化物的水化物两两之间可以发生反应
C.氢化物的稳定性:W>Z;氧化物水化物的酸性:W>Z
D.甲物质由Y和Z元素组成,溶于水后得到甲的水溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市高三年级4月考理综化学试卷(解析版) 题型:填空题
下表为元素周期表的一部分:
族 周期 |
|
|
| |||||
1 | ① |
|
|
|
|
|
|
|
2 |
|
|
|
|
| ② |
|
|
3 | ③ |
|
| ④ |
| ⑤ | ⑥ |
|
Ⅰ.请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)写出元素②的离子结构示意图______________。
(2)②、③、⑤的离子半径由大到小的顺序为_________________________。
(3)元素④与⑥形成化合物的电子式是_________________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
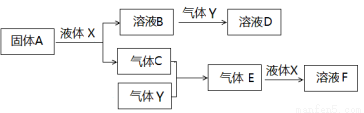
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为 。
(6)在500℃,101kPa时,气体C与气体Y反应生成0.2mol气体E时,放出akJ热量,写出该条件下反应的热化学方程式 。
(7)若气体C与Y在恒容绝热的条件下反应,下列说法能判断达到平衡状态的是 。
A.温度不变 B.气体总压强不变 C.混合气体的密度不变 D.混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源:2013-2014学年天津市七校高三4月联考理综化学试卷(解析版) 题型:填空题
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;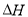 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;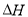 =-b kJ·mol-1
=-b kJ·mol-1
③E+A → A-E;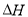 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);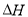 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 |
|
|
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率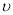 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
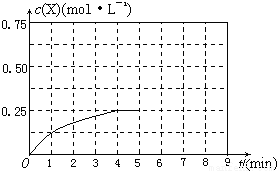
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:实验题
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
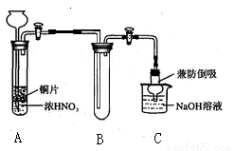
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是 。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是 。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是 。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
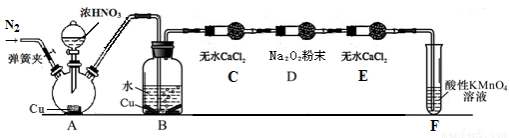
①B中观察到的主要现象是 ,F装置的作用是 。
②在反应前,打开弹簧夹,通入一段时间N2,目的是 。
③充分反应后,检验D装置中发生反应的实验是 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京顺义区高三第二次统练理综化学试卷(解析版) 题型:选择题
下列进行性质比较的实验,不合理的是
A.比较Cu、Fe的还原性:铜加入硫酸铁溶液中
B.比较氯的非金属性强于溴:溴化钠溶液中通入氯气
C.比较高锰酸钾的氧化性强于氯气:高锰酸钾中加入浓盐酸
D.比较镁的金属性强于铝:取一小段去氧化膜的镁带和铝片,分别加入1.0 mol·L-1的盐酸中
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市房山区高三一模理综化学试卷(解析版) 题型:填空题
大气中可吸入颗粒物PM2.5主要来源为燃煤、机动车尾气等。
(1)若取某PM2.5样本,用蒸馏水处理,测得溶液中含有的离子有:K+、Na+、NH4+、SO42-、NO3-、Cl-,则该溶液为 (填“酸性”或“碱性”)溶液,其原因用离子方程式解释是: 。
(2)“洗涤”燃煤烟气可减轻PM2.5中SO2的危害,下列可适用于吸收SO2的试剂有
A.CaCl2溶液 B.氨水 C.Ca(OH)2悬浊液 D.浓H2SO4
(3)煤烟气中的氮氧化物可用CH4催化还原成无害物质。若常温下,1molNO2与CH4反应,放出477.5kJ热量,该反应的热化学方程式是 。
(4)安装汽车尾气催化转化器也可减轻PM2.5的危害,其反应是:
2NO(g) + 2CO(g)  2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。
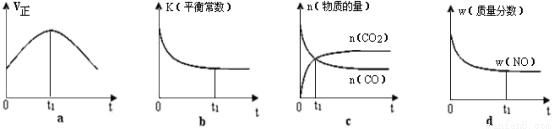
①该反应平衡常数表达式K= ;温度升高K值 (填“增大”或“减小” )
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 。
(5)使用锂离子电池为动力汽车,可减少有害气体的排放。锰酸锂离子蓄电池的反应式为:
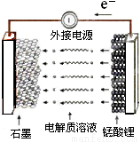 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C
下列有关说法正确的是
A.充电时电池内部Li+向正极移动
B.放电过程中,电能转化为化学能
C.放电时电池的正极反应式为:Li1-xMnO4+xe—+xLi+=LiMnO4
D.充电时电池的正极应与外接电源的负极相连
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市闵行区高三二模化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.35Cl、37 Cl为互为同位素,有不同的化学性质
B.氯气和二氧化硫使品红褪色的原理相同
C.浓硝酸和浓硫酸在空气中放置一段时间后浓度都会降低
D.卤化氢在空气中都能形成白雾,它们都是强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com